题目内容
10.474g KAl(SO4)2•12H2O中所含的K+、Al3+和SO42-的物质的量各是多少?所含H2O分子的数目是多少?氧原子的数目是多少?分析 根据物质的构成特点结合n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算该题.
解答 解:n(KAl(SO4)2•12H2O)=$\frac{474g}{474g/mol}$=1mol,则n(K+)=1mol,n(Al3+)=1mol,n(SO42-)=2mol,
n(H2O)=12mol,N(H2O)=12NA,N(O)=(2×4+12×1)NA=20NA,
答:K+、Al3+和SO42-的物质的量各是1mol、1mol、2mol,所含H2O分子的数目是12NA,氧原子的数目是20NA.
点评 本题考查物质的量的计算,为高频考点,把握物质的量与质量、微粒个数的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
20.请你运用所学的化学知识判断,下列有关的叙述错误的是( )
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源.保护环境 | |
| B. | 凡含有食品添加剂的食物对人体健康均有害,不可食用 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里 |
1.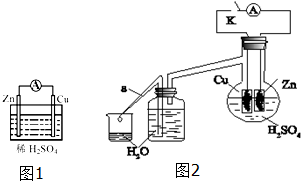 将锌片和铜片插入稀硫酸中构成如图1所示的装置,请回答下列问题:
将锌片和铜片插入稀硫酸中构成如图1所示的装置,请回答下列问题:
(1)该装置可以实现化学能转化为电能(填能量转化形式).
(2)对该装置下列说法正确的是bd.
a.Cu为正极发生氧化反应
b.负极反应为 Zn-2e-═Zn2+
c.电子由铜片通过导线流向锌片
d.溶液中SO42-移向Zn极
(3)在反应中若为了减缓反应速率但不减少产生氢气的量,可以采取的措施ac(填序号).
a.加水 b.加少量氯化钡固体 c.加少量醋酸钠固体 d.加少量氢氧化钠固体
(4)某学生为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行如图2实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如表所示:
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
 将锌片和铜片插入稀硫酸中构成如图1所示的装置,请回答下列问题:
将锌片和铜片插入稀硫酸中构成如图1所示的装置,请回答下列问题:(1)该装置可以实现化学能转化为电能(填能量转化形式).
(2)对该装置下列说法正确的是bd.
a.Cu为正极发生氧化反应
b.负极反应为 Zn-2e-═Zn2+
c.电子由铜片通过导线流向锌片
d.溶液中SO42-移向Zn极
(3)在反应中若为了减缓反应速率但不减少产生氢气的量,可以采取的措施ac(填序号).
a.加水 b.加少量氯化钡固体 c.加少量醋酸钠固体 d.加少量氢氧化钠固体
(4)某学生为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行如图2实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如表所示:
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
5.有下列物质:①铜,②稀硫酸,③HCl,④NH3,⑤空气,⑥CO2,⑦金属汞,⑧加入碘酸钾的食用盐,⑨碳酸钙,⑩氯气,⑪CaO,⑫SO3,⑬Na2O.
(1)请按照表中提示的信息,分别把符合左栏条件的物质的编号填人右栏相应的位置.
(2)题自所给的13种物质中.有无法填人上表中的吗?如果有的话,是什么物质?
(1)请按照表中提示的信息,分别把符合左栏条件的物质的编号填人右栏相应的位置.
| 符合的条件 | 物质的编号 |
| 混合物 | ②⑤⑧ |
| 电解质,但熔融状态并不导电 | ③ |
| 电解质,但难溶于水,也不与水反应 | ⑨ |
| 非电解质 | ④⑥⑫ |
| 既不是电解质,也不是非电解质,但本身能导电 | ①②⑦ |