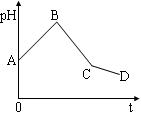
题目内容
用惰性电极电解NaCl与NaHCO3的混合溶液,测得溶液的pH变化如图所示。
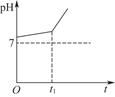
(1)在0→t1时间内,两个电极上的电极反应式为:
阳极:________________________________________________________________________;
阴极:________________________________________________________________________。
(2)用离子方程式表示0→t1时间内,溶液pH升高比较缓慢的原因:____________________________________________________________________________。

(1)在0→t1时间内,两个电极上的电极反应式为:
阳极:________________________________________________________________________;
阴极:________________________________________________________________________。
(2)用离子方程式表示0→t1时间内,溶液pH升高比较缓慢的原因:____________________________________________________________________________。
(1)2Cl--2e-=Cl2↑ 2H++2e-=H2↑
(2)HCO3-+OH-=CO32-+H2O
(2)HCO3-+OH-=CO32-+H2O
由于HCO3-、Na+均不易放电,故阳极反应式为2Cl--2e-=Cl2↑;阴极反应式为2H++2e-=H2↑。随着反应的进行c(OH-)增大,HCO3-+OH-=CO32-+H2O,故而开始pH变化缓慢,当HCO3-完全反应后,pH增幅加大。

练习册系列答案
相关题目

 H2 ↑
H2 ↑