题目内容
【题目】某同学为研究硫酸的性质,设计了以下实验。检查好装置的气密性后,在甲的试管中加入足量的Fe和少量的C,然后,加入少量浓硫酸。
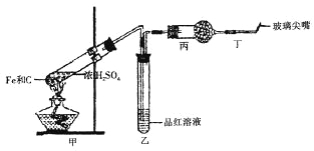
(1)在未点燃酒精灯时,乙中没有明显现象,这是因为____________;为处理生成的有毒气体,干燥管丙中应填充足量的____________。
(2)反应过程中甲中可能发生的反应为(写化学反应方程式): ____, , , 。
(3)接入该仪器后,点燃酒精灯,反应开始一段时间后,在丁处检验到某种无色无味气体,它是_______________。由于甲中加入了单质碳,使丁处产生气体的速率比不加入时快,这是因为_______________________。
【答案】(17分)(1)铁会钝化,未加热C与浓H2SO4不反应;碱石灰。(各2分)
(2)2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O
C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
Fe+Fe2(SO4)3=3FeSO4 Fe+H2SO4=FeSO4+H2↑(各2分)
(3)H2 因Fe、C与稀H2SO4构成原电池反应(各2分)
【解析】
试题分析:(1)常温下,Fe遇浓硫酸钝化,而C不与浓硫酸反应;反应有二氧化硫生成,可用碱石灰在干燥管内除掉二氧化硫;
(2)铁与浓硫酸加热反应生成硫酸铁:2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O,碳能被浓硫酸氧化为二氧化碳:C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O,碳能被浓硫酸氧化为二氧化碳:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;随反应进行,硫酸浓度变小,铁先与硫酸铁反应生成硫酸亚铁,再继续与稀硫酸反应生成氢气,反应方程式为Fe+Fe2(SO4)3=3FeSO4、Fe+H2SO4=FeSO4+H2↑;
CO2↑+2SO2↑+2H2O;随反应进行,硫酸浓度变小,铁先与硫酸铁反应生成硫酸亚铁,再继续与稀硫酸反应生成氢气,反应方程式为Fe+Fe2(SO4)3=3FeSO4、Fe+H2SO4=FeSO4+H2↑;
(3)随反应的进行,硫酸浓度变稀,铁与稀硫酸反应生成氢气,如甲中加入单质碳,铁与碳和硫酸形成原电池,原电池能加快化学反应速率。

 阅读快车系列答案
阅读快车系列答案