题目内容
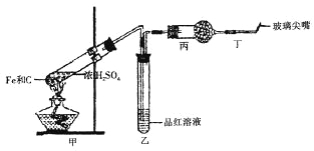
【题目】在下图的装置中,A是Cl2发生装置,C、D为气体净化装置,E是装有细铜丝网的硬质玻璃管,F为干燥的空广口瓶,烧杯G为尾气吸收装置。

(1)C中装有的试剂是 ,作用是 ;
(2)D中装有的试剂是 ,作用是 ;
(3)①写出装置A中发生反应的离子方程式: ,
②写出装置E中发生的反应的实验现象: ,
③写出装置G中发生反应的离子方程式: ,
④工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ,漂白粉的有效成分是_____________。(填化学式)
【答案】
(1)饱和食盐水,除去氯气中的HCl杂质气体;
(2)浓H2SO4,吸收水蒸气;
(3)①2C1-+4H++MnO2![]() Mn2++Cl2+2H2O;
Mn2++Cl2+2H2O;
②铜丝剧烈燃烧,产生棕黄色烟;
③Cl2+2OH-=Cl-+ClO-+H2O
④2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2。
【解析】
试题分析:二氧化锰与浓盐酸在加热条件下生成氯气和氯化锰和水,浓盐酸易挥发制取的氯气中含有氯化氢和水,依据氯气和氯化氢的水溶性选择合适的除杂剂,浓硫酸具有吸水性,可以干燥氯气,干燥的氯气与铁反应生成氯化铁,氯气有毒,不能直接排放到空气,氯气能够与氢氧化钠反应生成氯化钠和次氯酸钠,可用氢氧化钠吸收过量的氯气,氯气氧化性强能够与铁反应生成氯化铁。
(1)实验制备氯气中含杂质气体氯化氢和水蒸气,氯化氢易溶于饱和氯化钠溶,而饱和氯化钠溶液中含有大量的氯离子,抑制氯气的溶解,通过饱和食盐水的C可以除去氯气中的氯化氢,饱和食盐水;除去Cl2中的HCl杂质;
(2)浓硫酸具有吸水性,通过盛有浓硫酸的D可以除去氯气中的水蒸气,故答案为:浓硫酸;干燥Cl2;
(3)①A中二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,方程式:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
②装置E中铜丝在氯气中剧烈燃烧,产生棕黄色烟,故答案为:铜丝剧烈燃烧,产生棕黄色烟;
③G中氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠和水,方程式:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
④工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为2Cl2+ 2Ca(OH)2= CaCl2+Ca(ClO)2 +2H2O,漂白粉的有效成分是Ca(ClO)2,故答案为:2Cl2+ 2Ca(OH)2= CaCl2+Ca(ClO)2 +2H2O;Ca(ClO)2。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】下图是元素周期表的一部分
A | |||||||||||||||||
B | C | D | E | F | |||||||||||||
H | I | J | K | [Z | |||||||||||||
L | M | O |
(1)元素L的价电子排布图为 ,元素M的原子结构示意图为 ,位于元素周期表五个区域中的 区。上述元素中电负性最强的是 (用元素符号表示),C、D、E、F第一电离能的大小顺序为 (用元素符号表示)。
(2)D的氢化物和J氢化物沸点较高的是 (填化学式),稳定性更强的是 (填化学式)。
(3)某些不同族元素的性质也有一定的相似性,如上表中元素I与元素B的氢氧化物有相似的性质。写出元素B的氢氧化物与NaOH溶液反应的离子方程式 。
(4)A、E、H、J四种元素的原子半径由大到小的排列顺序为 (用元素符号表示);E、F、H、K四种元素简单离子的半径由大到小的排列顺序为 (用元素符号表示)。
(5)能证明元素K比元素J的非金属性强的事实是 (填序号)。
A.常温下K单质的密度小于J单质的密度
B.K元素的气态氢化物比J元素的气态氢化物更稳定
C.K单质与氢气反应的程度比J单质与氢气反应的程度更剧烈
D.K元素的氧化物对应的水化物酸性强于J元素的氧化物对应的水化物