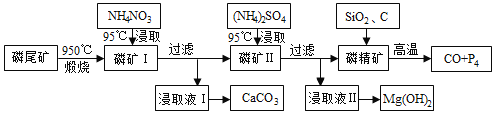
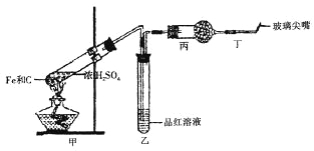
题目内容
【题目】分别处于第二、第三周期的主族元素A和B,它们的离子电子层结构相差两层,已知A处于第m族,B处于第n族,A只有正化合价,则A、B的原子序数分别是( )
A.m、n
B.3、7
C.m﹣2、10﹣n
D.m+2、n+10
【答案】D
【解析】解:A是第二周期主族元素,处于第m族,有2个电子层,最外层电子数为m,故其核外电子总数=原子序数=m+2; B是第三周期元素,处于第n族,有3个电子层,最外层电子数为n,故其核外电子总数=原子序数=2+8+n=n+10,
故选D.

练习册系列答案
相关题目
【题目】下图是元素周期表的一部分
A | |||||||||||||||||
B | C | D | E | F | |||||||||||||
H | I | J | K | [Z | |||||||||||||
L | M | O |
(1)元素L的价电子排布图为 ,元素M的原子结构示意图为 ,位于元素周期表五个区域中的 区。上述元素中电负性最强的是 (用元素符号表示),C、D、E、F第一电离能的大小顺序为 (用元素符号表示)。
(2)D的氢化物和J氢化物沸点较高的是 (填化学式),稳定性更强的是 (填化学式)。
(3)某些不同族元素的性质也有一定的相似性,如上表中元素I与元素B的氢氧化物有相似的性质。写出元素B的氢氧化物与NaOH溶液反应的离子方程式 。
(4)A、E、H、J四种元素的原子半径由大到小的排列顺序为 (用元素符号表示);E、F、H、K四种元素简单离子的半径由大到小的排列顺序为 (用元素符号表示)。
(5)能证明元素K比元素J的非金属性强的事实是 (填序号)。
A.常温下K单质的密度小于J单质的密度
B.K元素的气态氢化物比J元素的气态氢化物更稳定
C.K单质与氢气反应的程度比J单质与氢气反应的程度更剧烈
D.K元素的氧化物对应的水化物酸性强于J元素的氧化物对应的水化物