题目内容
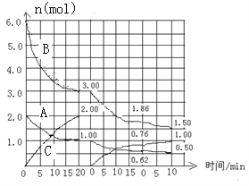
【题目】Ⅰ.反应:aA(g) + bB(g) ![]() cC(g) △H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
cC(g) △H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
回答问题:
(1)反应的化学方程式中,a:b:c == 。
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)比较第二阶段反应温度(T2)和第三阶段反应温度(T3)的高低:T2 T3(填“>”“<”或“=”),判断的理由是 。
(4)第三阶段平衡常数K3的计算式 。
Ⅱ.利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体。
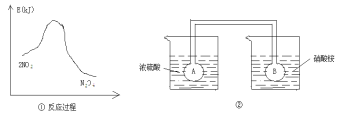
(5)B瓶中的气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。
【答案】Ⅰ.(1)1∶3∶2(2分)
(2)正反应方向(1分),移走生成物C(1分)
(3)>(2分),此反应为放热反应,降低温度,平衡向正反应方向移动(2分)
(4)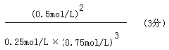
Ⅱ.(5)浅(1分),2NO2![]() N2O4 △H<0,A瓶加热,平衡左移颜色加深,B瓶降低温度,平衡右移颜色变浅(3分)
N2O4 △H<0,A瓶加热,平衡左移颜色加深,B瓶降低温度,平衡右移颜色变浅(3分)
【解析】
试题分析:Ⅰ.(1)由图可知第Ⅰ阶段,平衡时△c(A)=2mol/L-1mol/L=1mol/L,△c(B)=6mol/L-3mol/L=3mol/L,△c(C)=2mol/L,浓度变化量之比等于化学计量数之比,故a:b:c=1mol/L:3mol/L:2mol/L=1:3:2;
(2)第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动;
(3)第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,另外结合A的速率在三个阶段的情况,确定改变的条件一定为降低温度,根据勒夏特列原理,平衡的移动只能减弱改变,不能抵消改变,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低;
(4)平衡常数= ![]() =
=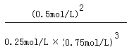
Ⅱ.(5)加入浓硫酸的烧杯中因浓硫酸稀释放热,温度升高,加入硝酸铵的烧杯温度降低。2NO2![]() N2O4 反应放热,温度降低,平衡正向移动,颜色变浅。
N2O4 反应放热,温度降低,平衡正向移动,颜色变浅。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案