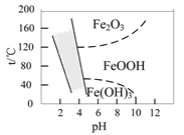
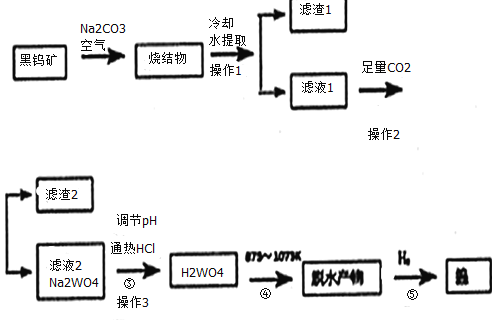
题目内容
【题目】A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如下图所示,其中A为澄清溶液,C为难溶于水的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。请回答下列问题:

(1)写出化学式:A__________C__________
(2)写出下列反应的离子方程式:
A→B:________________________________。
B→D:________________________________。
C→E:________________________________。
【答案】 KAlO2 Al2O3 ![]() +CO2+2H2O===Al(OH)3↓+
+CO2+2H2O===Al(OH)3↓+![]() Al(OH)3+3H+===Al3++3H2O Al2O3+2OH===2
Al(OH)3+3H+===Al3++3H2O Al2O3+2OH===2![]() +H2O
+H2O
【解析】B、C都既能与盐酸反应又能与NaOH溶液反应,应为两性化合物,因B加热分解可生成C,则可知B为Al(OH)3,C为A12O3,则D为AlCl3,E为NaAlO2,若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片),说明A中含有K元素,A能与二氧化碳反应生成Al(OH)3,则A应为KAlO2,(1)通过以上分析知,A、B、C、D、E分别是KAlO2、Al(OH)3、A12O3、AlCl3、NaAlO2;(2)A→B的反应为AlO2-和Al(OH)3的转化,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,B→D的反应的离子方程式为Al(OH)3+3H+═Al3++3H2O,C→E的反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如下:
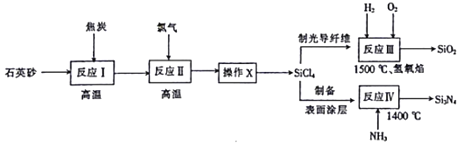
回答下列问题:
(1)反应Ⅰ的化学方程式为2C+SiO2 ![]() Si+2CO↑,其中还原剂为______,产物Si在周期表中位于______,该反应涉及的副反应可能有C+SiO2
Si+2CO↑,其中还原剂为______,产物Si在周期表中位于______,该反应涉及的副反应可能有C+SiO2 ![]() Si+CO2↑(碳不足)和______(碳足量)。
Si+CO2↑(碳不足)和______(碳足量)。
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如下:
组分名称 |
|
|
| HCl |
|
|
质量分数 |
|
|
|
|
|
|
沸点 |
|
|
|
|
|
|
图中“操作X”的名称为______;![]() 的电子式为______。
的电子式为______。
(3)反应Ⅳ的化学方程式为3SiCl4+4NH3 ![]() Si3N4+12HCl,若向2L恒容密闭容器中投入1mol
Si3N4+12HCl,若向2L恒容密闭容器中投入1mol![]() 和1mol
和1mol![]() ,6min后反应完全,则
,6min后反应完全,则![]() min内,HCl的平均反应速率为______molL-lmin-l;反应Ⅲ的与Ⅳ产生的气体相同,则反应Ⅲ化学方程式为______。反应Ⅲ中的原料气
min内,HCl的平均反应速率为______molL-lmin-l;反应Ⅲ的与Ⅳ产生的气体相同,则反应Ⅲ化学方程式为______。反应Ⅲ中的原料气![]() 和
和![]() 在碱性条件下可构成燃料电池,其正极反应的电极方程式为______。
在碱性条件下可构成燃料电池,其正极反应的电极方程式为______。