题目内容
【题目】在容积为 2L 的密闭容器中进行如下反应:A g + 2Bg ![]() 3Cg + nDg ,开始时 A 为 4mol,B 为 6mol,5min 末时测得 C 的物质的量为 3mol,D 的化学反应速率vD = 0.2mol L1 min1 ,请回答:
3Cg + nDg ,开始时 A 为 4mol,B 为 6mol,5min 末时测得 C 的物质的量为 3mol,D 的化学反应速率vD = 0.2mol L1 min1 ,请回答:
(1)5min 末A 的物质的量浓度为_____,
(2)前 5min 内用B 表示的化学反应速率 v(B)为_____,
(3)前 5min 内A 的转化率为_____,
(4)化学方程式中 n 的值为_____,
(5)此反应在四种不同情况下的反应速率分别为:
① v A = 5mol L1 min1 ② v B = 6mol L1 min1
③ v C = 4.5mol L1 min1 ④ v D = 8mol L1 min1
其中反应速率最快的是_____(填编号)。
【答案】1.5mol L1 0.2 mol L1 min1 25% 2 ①
【解析】
(4)根据同一反应中、同一时间段内,各物质的反应速率之比等于计量数之比确定n值;
(5)把不同物质的反应速率换算成同一物质的反应速率进行比较,即用反应速率(单位需一致)除以化学计量数,数值大的反应速率快;
列出三段式: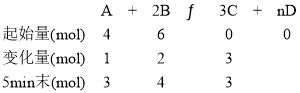 ,
,
(1)5min 末A 的物质的量浓度为![]() ,故答案为:1.5mol L1;
,故答案为:1.5mol L1;
(2)前 5min 内用B 表示的化学反应速率![]() ,故答案为:0.2 mol L1 min1;
,故答案为:0.2 mol L1 min1;
(3)前 5min 内A 的转化率为![]() ,故答案为:25%;
,故答案为:25%;
(4)根据同一反应中、同一时间段内,各物质的反应速率之比等于计量数之比;所以![]() ,解得n=2,故答案为:2;
,解得n=2,故答案为:2;
(5)比较四种不同情况下的反应速率,用化学反应速率除以化学计量数,数值越大的,反应速率越快,则①![]() ,②
,②![]() ,③
,③![]() ,④
,④![]() ,则其中反应速率最快的是①,故答案为:①。
,则其中反应速率最快的是①,故答案为:①。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
②____________ | 反应物浓度越大,反应速率越快 |
(1)甲同学表中实验步骤②为_________________________________________。
(2)甲同学的实验目的是_____________;要得出正确的实验结论,还需控制的实验条件是____________。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是___________________________________________________。
(4)乙同学完成该实验应选用的实验药品是________,该实验中不选用某浓度的硫酸,理由是___________。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________(填字母)。
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
【题目】工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。反应原CH2=CH2(g)+H2O(g)=CH3CH2OH(g )△H。已知几种共价键的键能如下:
化学键 | C-H | C=C | H-O | C-C | C-O |
键能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是
A. 上述合成乙醇的反应原子利用率为100%
B. 相同时间段内,用该反应中三种物质表示的该反应的化学反应速率相等
C. 碳碳双键的键能大于碳碳单键键能,但碳碳单键更稳定
D. 上述反应式中,△H=+34kJ·mol-1
【题目】(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____。又已知:H2O(g)=H2O(l);△H2=﹣44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是___kJ。
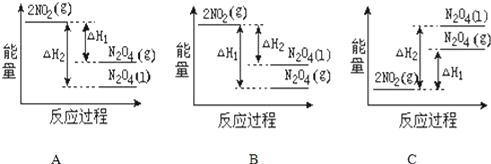
(2)已知:2NO2(g)═N2O4(g) △H1 2NO2(g)═N2O4(l) △H2,下列能量变化示意图中,正确的是(选填字母)______。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2 599kJmol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:__。
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH)。已知某些化学键的键能数据如表:
化学键 | C﹣C | C﹣H | H﹣H | C﹣O | C≡O | H﹣O |
键能/kJmol﹣1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为_______。