题目内容
6.将同温同压下H2、O2、Cl2按9:4:1的体积比混合,在密闭容器中用电火花点燃充分反应后,使混合气体冷却到室温,所得溶液的质量分数为( )| A. | 37% | B. | 33.6% | C. | 16.8% | D. | 20% |
分析 同温同压下H2、O2、Cl2按9:4:1的体积比混合,同温同压下,气体体积之比等于物质的量之比,所以H2、O2、Cl2的物质的量之比为9:4:1,设它们的物质的量分别是9mol、4mol、1mol,
发生的反应为2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,根据方程式知,氧气完全反应需要8mol氢气,剩余的1mol氢气和1mol氯气恰好反应生成2molHCl,则溶质为HCl,溶剂为H2O,根据原子守恒得n(HCl)=2n(Cl2)=2mol,m(HCl)=2mol×36.5g/mol=73g,n(H2O)=4n(O2)=8mol,m(H2O)=8mol×18g/mol=144g,溶液质量=m(H2O)+m(HCl)=144g+73g=217g,据此分析解答.
解答 解:同温同压下H2、O2、Cl2按9:4:1的体积比混合,同温同压下,气体体积之比等于物质的量之比,所以H2、O2、Cl2的物质的量之比为9:4:1,设它们的物质的量分别是9mol、4mol、1mol,
发生的反应为2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,根据方程式知,氧气完全反应需要8mol氢气,剩余的1mol氢气和1mol氯气恰好反应生成2molHCl,则溶质为HCl,溶剂为H2O,根据原子守恒得n(HCl)=2n(Cl2)=2mol,m(HCl)=2mol×36.5g/mol=73g,n(H2O)=4n(O2)=8mol,m(H2O)=8mol×18g/mol=144g,溶液质量=m(H2O)+m(HCl)=144g+73g=217g,溶液质量分数=$\frac{73g}{217g}$×100%=33.6%,故选B.
点评 本题考查混合物的有关计算,侧重考查学生分析计算能力,明确各个物理量之间的关系即可解答,题目难度不大.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | 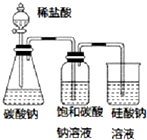 图中的实验现象能证明非金属性:Cl>C>Si | |
| B. | 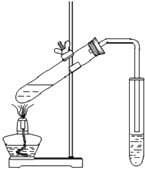 图可用于实验室制备并收集乙酸乙酯 | |
| C. |  图中,气体从a口进入时,可用于收集H2、CH4、NH3等气体 | |
| D. | 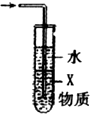 图中X若为CCl4,可用于吸收NH3或HCl |
| A. | 1:3:5 | B. | 5:1:3 | C. | 3:1:5 | D. | 2:4:3 |
| A. | 氧化亚铁和稀硝酸反应FeO+2H+═Fe2++H2O | |
| B. | 硫酸铝溶液与足量烧碱:Al3++3OH-=Al(OH)3↓ | |
| C. | 氯化亚铁溶液中滴入氯水Cl2+2Fe2+═2Cl-+2Fe3+ | |
| D. | 金属铝投入NaOH溶液中2Al+2OH-+2H2O═2AlO${\;}_{2}^{-}$+2H2↑ |
| A. | 中子数为20的氯原子:37Cl | B. | Cl-的结构示意图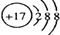 | ||
| C. | 氢氧根离子的电子式: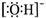 | D. | HClO的结构式 H-Cl-O |
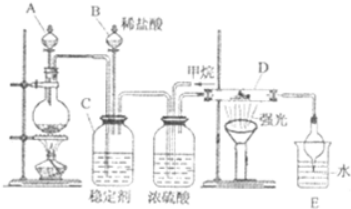 氯及其化合物在合成消毒剂、药物等方面具有广泛用途.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,某兴趣小组通过如图装置,对二氧化氯及氯气的性质进行了研究:
氯及其化合物在合成消毒剂、药物等方面具有广泛用途.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,某兴趣小组通过如图装置,对二氧化氯及氯气的性质进行了研究:
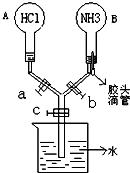 如图所示的装置,实验前a、b、c活塞均关闭.
如图所示的装置,实验前a、b、c活塞均关闭.