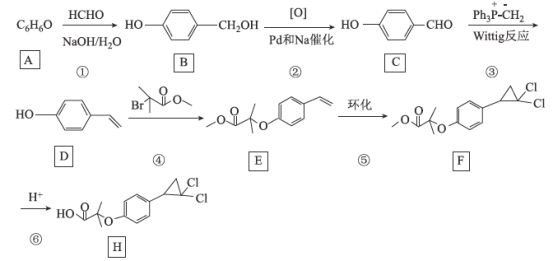
题目内容
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2 析出,依据I2 析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1的NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝的时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
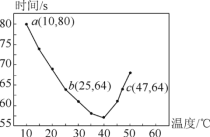
A. 40℃之前与40℃之后溶液变蓝时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3的平均反应速率一定相等
C. 图中a点对应的NaHSO3的平均反应速率为5.0×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
【答案】B
【解析】
A. 从图象中可以看出,40℃以前温度越高,反应速度越快;40℃后温度越高,变色时间越长反应越慢,A项正确;
B.b、c点对应的温度不同,故反应速率不同,B项错误;
C. a点时间为80s,浓度变化量为![]() = 0.004mol/L,a点对应的NaHSO3反应速率为5.0×105molL1s1,C项正确;
= 0.004mol/L,a点对应的NaHSO3反应速率为5.0×105molL1s1,C项正确;
D. 55℃时没有出现蓝色,说明当温度高于40℃时,淀粉的水解速率随温度升高而明显加快,故淀粉已不能作为该反应的指示剂,D项正确;
答案选B。

【题目】TK时,向2.0 L恒容密闭容器中充入0.10 mol COCl2,发生反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.022 mol·L-1,则反应的ΔH<0
B. 反应在前2 s的平均速率v(CO)=0.015 mol·L-1·s-1
C. 保持其他条件不变,起始向容器中充入0.12 mol COCl2、0.06 mol Cl2和0.06 mol CO,反应达到平衡前的速率:v正<v逆
D. 保持其他条件不变,起始向容器中充入0.10 mol Cl2和0.08 mol CO,达到平衡时,Cl2的转化率小于60%
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)①将合成气以n(H2)∶n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是__(填字母)。
CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是__(填字母)。
A. ΔH<0
B. p1<p2<p3
C. 若在p3和316 ℃时,起始时n(H2)∶n(CO)=3,则达到平衡时,CO转化率小于50%

②采用一种新型的催化剂(主要成分是Cu-Mn合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题:催化剂中n(Mn)/n(Cu)约为____时最有利于二甲醚的合成。
(2)CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH_____0(填“>”或“ <”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH_____0(填“>”或“ <”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______。

(3)在一定条件下,可发生反应6H2(g)+2CO2(g)![]() CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
500K | 600K | 700K | 800K | |
n(H2)∶n(CO2)=1.5 | 45 | 33 | 20 | 12 |
n(H2)∶n(CO2)=2 | 60 | 43 | 28 | 15 |
n(H2)∶n(CO2)=3 | 83 | 62 | 37 | 22 |
根据上表中数据
①温度一定时,提高氢碳比n(H2)∶n(CO2)],CO2的转化率__(填“增大”、“减小”或“不变”)。
②该反应的正反应为___热反应(填“吸”或“放”)。
【题目】如图所示,将大烧杯丙扣在甲乙两个小烧杯(口向上)上。向两个小烧杯中分别装入如下表所列的试剂进行实验。实验现象与预测现象不同的是
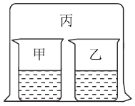
甲中试剂 | 乙中试剂 | 预测现象 | |
A | 浓盐酸 | 硝酸银溶液 | 乙中产生白色沉淀 |
B | 浓氨水 | 硫酸铁溶液 | 乙中产生红褐色沉淀 |
C | 浓盐酸 | 浓氨水 | 丙中产生白色烟雾 |
D | 氯化铝溶液 | 浓氨水并加入 固体氢氧化钠 | 甲中先产生白色沉淀,后又沉淀消失 |
A. AB. BC. CD. D