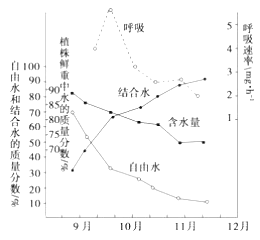
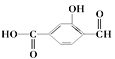
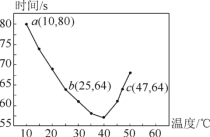
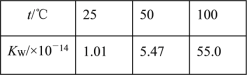题目内容
【题目】将一定量锌与 100mL18mol/L 浓硫酸充分反应后,若锌完全溶解同时产生气体 0.8mol, 将反应后的溶液稀释得 40mL,测得溶液 c(H+)=2mol/L,则下列叙述中错误的是
A. 气体中 SO2 和 H2 物质的量比为 6:1B. 反应中共消耗锌 52.0g
C. 所得气体应该为 SO2 和 H2 混合物D. 反应共转移电子 1.6mol
【答案】A
【解析】
Zn和浓硫酸发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,随着反应的进行,溶液浓度减小,稀硫酸与Zn发生:Zn+H2SO4(稀)=ZnSO4+H2↑,则生成的气体为SO2和的H2混合物,根据反应的有关方程式结合质量守恒定律列方程组计算。
生成气体的物质的量为0.8mol,溶液剩余硫酸的物质的量为![]() ×0.4L×2mol/L=0.4mol,参加反应的n(H2SO4)=0.1L×18mol/L-0.4mol=1.4mol,随着反应的进行,硫酸的浓度逐渐减小,设反应生成xmolSO2,ymolH2,
×0.4L×2mol/L=0.4mol,参加反应的n(H2SO4)=0.1L×18mol/L-0.4mol=1.4mol,随着反应的进行,硫酸的浓度逐渐减小,设反应生成xmolSO2,ymolH2,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2xx
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
x+y=0.8、2x+y=1.4,解之得 x=0.6,y=0.2,所以反应会生成0.6mol的二氧化硫和0.2mol的氢气;
A.气体中SO2和H2物质的量比为3:1,故A错误;
B.生成1mol混合气体转移2mol电子,消耗1mol的锌,所以反应中共消耗金属Zn的质量m(Zn)=0.8×65g/mol=52g,故B正确;
C.由以上分析可知气体A为SO2和H2的混合物,故C正确;
D.生成1mol混合气体转移2mol电子,所以反应共转移电子1.6mol,故D正确;故答案为A。

 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案