题目内容
【题目】某研究小组欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2。Na2O2样品与过量水反应,待完全反应不再产生氧气后,得溶液X。查阅资料表明,Na2O2与水反应还可生成H2O2。
(1)写出Na2O2与水生成O2的化学反应方程式______________,每生成1mol O2,转移电子的物质的量为______________。
(2)Na2O2与水反应生成H2O2的反应是否属于氧化还原反应_______(填是、否)。
(3)若已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,完成并配平该反应的离子方程式:____MnO4-+____H2O2+____H+—____Mn2++____O2↑+____ 。____________
(4)取40 gNa2O2固体粉末与一定量二氧化碳反应后,固体质量变为47g,则该反应中消耗Na2O2的质量是________g。
【答案】2Na2O2+2H2O=O2↑+4NaOH 2mol 否 2,5,6,2,5,8H2O 19.5g
【解析】
(1)Na2O2与水反应生成O2的化学方程式为2Na2O2+2H2O=4NaOH+O2↑。反应中每生成1molO2转移2mol电子。
(2)Na2O2与水反应生成H2O2的反应不是氧化还原反应。
(3)用化合价升降法配平氧化还原反应。
(4)用增量法解题。
(1)Na2O2与水反应生成O2的化学方程式为2Na2O2+2H2O=4NaOH+O2↑。用单线桥分析该反应为:![]() ,反应中每生成1molO2转移2mol电子。
,反应中每生成1molO2转移2mol电子。
(2)Na2O2与水反应生成H2O2的化学方程式为Na2O2+2H2O=2NaOH+H2O2,反应前后元素的化合价没有发生变化,Na2O2与水反应生成H2O2的反应不是氧化还原反应。
(3)反应中,Mn元素的化合价由+7价降至+2价,1molMnO4-得到5mol电子生成1molMn2+,O元素的化合价由-1价升至0价,1molH2O2失去2mol电子生成1molO2;根据得失电子守恒守恒配平为2MnO4-+5H2O2+H+→2Mn2++5O2↑,结合原子守恒、电荷守恒以及溶液呈酸性,离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O。
(4)2Na2O2+2CO2=2Na2CO3+O2~Δm(增重)
2×78g 2×106g 2×106g-2×78g=56g
m(Na2O2) 47g-40g=7g
![]() =
=![]() ,解得m(Na2O2)=19.5g
,解得m(Na2O2)=19.5g
该反应中消耗Na2O2的质量是19.5g。

【题目】原子序数由小到大排列的四种短周期元素 X、Y、Z、W,四种元素的原子序数之和为 32,在周期表中 X 是原子半径最小的元素,Y、Z 左右相邻,Z、W 位于同主族。
(1)W 原子的核外电子排布式为__________________。
(2)均由 X、Y、Z 三种元素组成的三种常见物质 A.、B、C 分别属于酸、碱、盐,其化学式依次 为________________ 、__________________ 、____________________,推测盐中阴离子的空间构型为___________ ,其中心原子杂化方式为_________________________。
(3)Z、W 两种元素电负性的大小关系为___________ (填“大于”“等于”或“小于”);Y、Z 两种元素第 一电离能的大小关系为________________ (填“大于”“等于”或“小于”)。
(4)CO 的结构可表示为C≡O,元素Y 的单质Y2 的结构也可表示为Y≡Y。下表是两者的键能数据(单位:kJmol1):
AB | A═B | A≡B | |
CO | 357.7 | 798.9 | 1071.9 |
Y2 | 154.8 | 418.4 | 941.7 |
①结合数据说明 CO 比 Y2 活泼的原因:_________________________。
②意大利罗马大学 FulvioCacace 等人获得了极具研究意义的 Y4 分子,其结构如图所示,请结合上表数 据分析,下列说法中,正确的是_____。
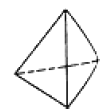
a. Y4 为一种新型化合物
b. Y4 与 Y2 互为同素异形体
c. Y4 的沸点比 P4(白磷)高
d. 1mol Y4 气体转变为 Y2 将放出 954.6kJ 热量
【题目】(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为_____________,CO有多种等电子体,其中常见的一种分子是__________。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有_____个δ键,C原子的杂化方式为__________。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是__________,形成的化学键是___________。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
写出A原子的电子排布图_______________,Al原子的第一电离能_____(填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是_________________。


