题目内容
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是

【答案】C
【解析】
试题分析:A.50mL1mol![]() L-1HCl中n(HCl)=1mol/L×0.05L=0.05mol,二者恰好完全反应生成0.05mol NaHCO3,由于水解程度大于电离程度,所以反应结束后,c(H2CO3) >c(CO32-),故A错误;B.CaO和水反应生成氢氧化钙,二者反应生成CaCO3沉淀和NaOH,所以溶液中
L-1HCl中n(HCl)=1mol/L×0.05L=0.05mol,二者恰好完全反应生成0.05mol NaHCO3,由于水解程度大于电离程度,所以反应结束后,c(H2CO3) >c(CO32-),故A错误;B.CaO和水反应生成氢氧化钙,二者反应生成CaCO3沉淀和NaOH,所以溶液中![]() 增大,故B错误;C.Na2CO3在溶液中水解促进水的电离使溶液呈碱性,加入50mL H2O后溶液碱性减弱,由水电离出的c(H+)
增大,故B错误;C.Na2CO3在溶液中水解促进水的电离使溶液呈碱性,加入50mL H2O后溶液碱性减弱,由水电离出的c(H+)![]() c(OH—)减小,故C正确;D.加入0.1mol硫酸氢钠,二者恰好反应生成硫酸钠、水和二氧化碳,硫酸氢钠能电离出钠离子而导致溶液中c(Na+)增大,溶液的pH减小,故D错误。
c(OH—)减小,故C正确;D.加入0.1mol硫酸氢钠,二者恰好反应生成硫酸钠、水和二氧化碳,硫酸氢钠能电离出钠离子而导致溶液中c(Na+)增大,溶液的pH减小,故D错误。

【题目】硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等。
(1)新制的绿矾(FeSO4·7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式: 。
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃。
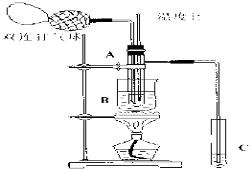
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”。
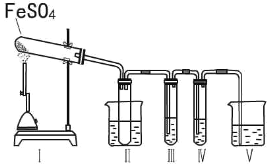
上述装置Ⅲ和Ⅳ用来检验气体产物。试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是 。
②装置Ⅲ中的试剂可以是 (选填序号,下同),现象是 ,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是 。
A.2mol/LNa2CO3溶液
B.品红溶液
C.0.5mol/L BaCl2溶液
D.0.5mol/LBa(NO3)2
E.0.01mol/L KMnO4溶液
F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为 。
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
操作步骤 | 预期实验现象 | 预期实验结论 |
向其中一份溶液中加入 | 固体中含有Fe2O3 | |
向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 |
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数= (精确到0.1%)
【题目】某实验室小组偶然发现将镁条插入饱和NaHCO3溶液中,镁条表面出现大量气泡。为了探究产生此现象的原因,该小组设计实验探究如下:
(1)用固体NaHCO3配置饱和NaHCO3溶液的操作过程 。
饱和NaHCO3溶液pH=8.4,用离子方程式表示 。
(2)请完成以下实验设计(镁条已擦去氧化膜且表面积大致相同。表中不要留空格):
序号 | 实验操作 | 实验现象 | 实验结论 |
1 | 将镁条投入5ml蒸馏水 | 微量气泡 | |
2 | 将镁条投入5ml饱和NaHCO3溶液中 | Mg与NaHCO3溶液剧烈反应 | |
3 | 将镁条投入5ml pH= NaOH溶液中 | 现象不明显 | Mg与NaOH溶液较难反应 |
(3)对于反应②中产生的气体(不考虑水蒸气),请你完成假设二和假设三:
假设一:只有CO2;假设二:只有 ;假设三:
(各1分)
为检验其中是否含有CO2,写出实验步骤和结论。
实验步骤 | 想象和结论 |
大试管中加入擦去氧化膜的镁条
|