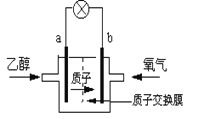
题目内容
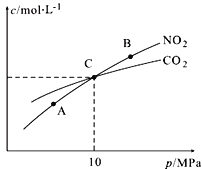
【题目】已知:pAg=-lg(Ag+),Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol![]() L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl) >Ksp(AgI)]
L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl) >Ksp(AgI)]
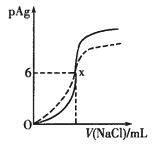
A.相同温度下,AgCl在纯水和在NaCl溶液中的溶解度相等
B.原AgNO3溶液的物质的量浓度为0.1mol![]() L-1
L-1
C.图中x点的坐标为(100,6)
D.把0.1mol![]() L-1的NaCl溶液换成0.1mol
L-1的NaCl溶液换成0.1mol![]() L-1的NaI溶液则图像变为虚线部分
L-1的NaI溶液则图像变为虚线部分
【答案】C
【解析】
试题分析:A.AgCl在水中存在如何平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),相同温度下,浓度增大平衡逆向移动,溶解度减小。所以,AgCl在纯水比在NaCl溶液中的溶解度大,故A错误;B.图中原点pAg=0,则Ag+的浓度为:c(Ag+)=100 mol
Ag+(aq)+Cl-(aq),相同温度下,浓度增大平衡逆向移动,溶解度减小。所以,AgCl在纯水比在NaCl溶液中的溶解度大,故A错误;B.图中原点pAg=0,则Ag+的浓度为:c(Ag+)=100 mol![]() L-1,即原AgNO3溶液的物质的量浓度为1 mol
L-1,即原AgNO3溶液的物质的量浓度为1 mol![]() L-1,故B错误;C.x点c(Ag+)=10-6 mol
L-1,故B错误;C.x点c(Ag+)=10-6 mol![]() L-1,一般认为溶液中离子浓度小于10-6 mol
L-1,一般认为溶液中离子浓度小于10-6 mol![]() L-1,即沉淀完全,则AgNO3与NaCl恰好反应,n(NaCl)=n(AgNO3)=0.01L×1mol
L-1,即沉淀完全,则AgNO3与NaCl恰好反应,n(NaCl)=n(AgNO3)=0.01L×1mol![]() L-1=0.01mol,所以V(NaCl)=100mL,即x点的坐标为(100,6),故C正确;D.与AgCl相比,碘化银的Ksp(AgI)更小,所以把0.1 mol
L-1=0.01mol,所以V(NaCl)=100mL,即x点的坐标为(100,6),故C正确;D.与AgCl相比,碘化银的Ksp(AgI)更小,所以把0.1 mol![]() L-1的NaCl换成0.1mol
L-1的NaCl换成0.1mol![]() L-1NaI,则溶液中c(Ag+)更小,则pAg更大,图象不符,故D错误。
L-1NaI,则溶液中c(Ag+)更小,则pAg更大,图象不符,故D错误。

 培优好卷单元加期末卷系列答案
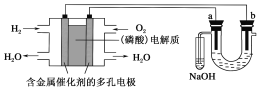
培优好卷单元加期末卷系列答案【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。(已知:S2O32-+2H+=H2O+S↓+SO2↑)

(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是_______________;除如图装置所示的实验用品、仪器外,还需要的意见实验仪器是__________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是________________________。
(3)试简述测定该反应的化学反应速率的其他方法:__________________(写一种)。
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(4)该实验进行的目的是_____________淀粉溶液的作用是____________。
(5)表中Vx=_______mL,比较t1、t2、t3大小,试推测该实验结论: ____________