题目内容
已知某可逆反应mA(g)+ nB(g) pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )
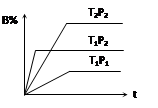
 pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )
| A.T1<T2、P1>P2、m+n>p,⊿H <0; |
| B.T1>T2、P1<P2、m+n>p,⊿H >0; |
| C.T1>T2、P1<P2、m+n<p,⊿H >0; |
| D.T1<T2、P1>P2、m+n<p,⊿H <0; |
C
先看清横纵轴的意义:横轴表示时间,纵轴表示B的百分含量;
然后看线的走向:“T1P2、T2P2”线比较:在相同压强下,达平衡用时少的,温度高,即:T1 >T2;
“T1P1、T1P2”线比较:在相同温度下,达平衡用时少的,压强高,即:P2 >P1;
然后再看平行线部分:T1到T2(降温),B的百分含量增大,即平衡左移,说明逆向是放热的,则⊿H >0;
P1到P2(增压),B的百分含量增大,即平衡左移,说明逆向是气体体积减小的方向,则m+n<p;
然后看线的走向:“T1P2、T2P2”线比较:在相同压强下,达平衡用时少的,温度高,即:T1 >T2;
“T1P1、T1P2”线比较:在相同温度下,达平衡用时少的,压强高,即:P2 >P1;
然后再看平行线部分:T1到T2(降温),B的百分含量增大,即平衡左移,说明逆向是放热的,则⊿H >0;
P1到P2(增压),B的百分含量增大,即平衡左移,说明逆向是气体体积减小的方向,则m+n<p;

练习册系列答案
相关题目
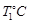 时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g)
时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g) 2NH3(g);
2NH3(g);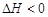 ,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。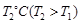 时的H2体积分数随时间t的变化曲线。
时的H2体积分数随时间t的变化曲线。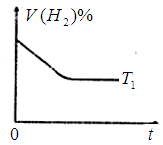
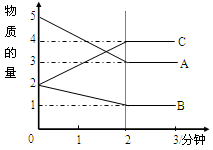
 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示下列判断正确的是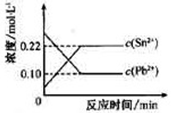
 2HBr(g)。已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr(见下表的“已知”项),在相同条件下,且保持平衡时各组分的含量不变,对下列编号(1)~(3)的状态,填写表中的空白。
2HBr(g)。已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr(见下表的“已知”项),在相同条件下,且保持平衡时各组分的含量不变,对下列编号(1)~(3)的状态,填写表中的空白。 FeO(s)+CO(g) △H1,平衡常数为K1
FeO(s)+CO(g) △H1,平衡常数为K1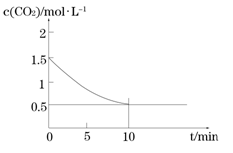
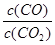 增大的是 (填序号)
增大的是 (填序号) Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题: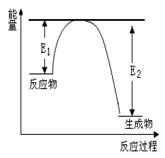
 (正)
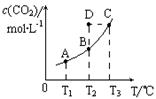
(正)  CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是