题目内容
(12分)(一)、下列各项分别与哪个影响化学反应速率的因素的关系最为密切?
(1)硫在氧气中比在空气中燃烧剧烈
(2)MnO2加入双氧水中反应更剧烈
(3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完
(4)镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生
(二)、氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2 + 6C + 2N2 Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
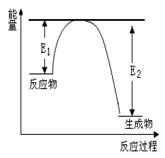
(1)上述反应中的还原剂是 ,还原产物是 。
(2)若反应中测得生成4.48 L CO气体(标准状况下),则转移的电子数为 。
(3)该反应是 (填“吸热”或“放热”)反应。
(三)、在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
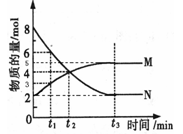
(1)写出该反应的化学方程式为 。
(2)比较t2时刻,正逆反应速率大小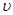 (正)
(正) 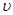 (逆)。(填“>”、“=”、“<”)。.
(逆)。(填“>”、“=”、“<”)。.
(3)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为 。
(4)t3时刻化学反应达到平衡时反应物的转化率为 。
(1)硫在氧气中比在空气中燃烧剧烈
(2)MnO2加入双氧水中反应更剧烈
(3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完
(4)镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生
(二)、氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2 + 6C + 2N2
 Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
(1)上述反应中的还原剂是 ,还原产物是 。
(2)若反应中测得生成4.48 L CO气体(标准状况下),则转移的电子数为 。
(3)该反应是 (填“吸热”或“放热”)反应。
(三)、在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:

(1)写出该反应的化学方程式为 。
(2)比较t2时刻,正逆反应速率大小
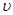 (正)
(正) 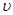 (逆)。(填“>”、“=”、“<”)。.
(逆)。(填“>”、“=”、“<”)。.(3)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为 。
(4)t3时刻化学反应达到平衡时反应物的转化率为 。
(一) (1)氧气的浓度或密度;(2)催化剂;
(3)固体的表面积或接触面积;(4)温度。
(二) (1)C; Si3N4。 (2)0.4NA或2.408×1023。 (3)放热。
(三)(1)2N M;(不写可逆符号不得分)(2)>;
M;(不写可逆符号不得分)(2)>;
(3)0.25mol /(L·min)(不写单位不得分);(4)75%或3/4。
(3)固体的表面积或接触面积;(4)温度。
(二) (1)C; Si3N4。 (2)0.4NA或2.408×1023。 (3)放热。
(三)(1)2N
 M;(不写可逆符号不得分)(2)>;
M;(不写可逆符号不得分)(2)>;(3)0.25mol /(L·min)(不写单位不得分);(4)75%或3/4。
(二)(1) 0 0 -3 +2
3SiO2 + 6C + 2N2 Si3N4 + 6CO
Si3N4 + 6CO
在反应中,C化合价升高,被氧化,做还原剂;N2化合价降低,被还原,得还原产物Si3N4;
(2)由方程式,得:6 CO — 12e-,标准状况下4.48 L CO的物质的量为0.2mol,则转移的电子数为:0.2mol×2×NA="0.4" NA;
(3)分析图像,得:反应物总能量>生成物总能量,所以为放热反应;
(三)(1)分析图像,得:N减少,则N为反应物,M增多,则M为生成物;且N未减少到零,到t3后保持一定值,说明达到了平衡,则N生成M是一个可逆反应:
N M
M
n0 8 2
n(平衡) 2 5 ,得:△n(N):△n(M)=6:3=方程式中的化学计量系数之比,
所以:该反应的化学方程式为2N M;
M;
(2)t2时刻,反应还没有达到平衡状态,且反应在正向进行,故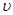 (正)>
(正)>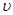 (逆);
(逆);
(3)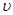 (M)=[(4-2)mol/4L]/2min=0.25mol /(L·min)
(M)=[(4-2)mol/4L]/2min=0.25mol /(L·min)
(4)反应物的转化率=(8-2)/8=75%
3SiO2 + 6C + 2N2
 Si3N4 + 6CO
Si3N4 + 6CO在反应中,C化合价升高,被氧化,做还原剂;N2化合价降低,被还原,得还原产物Si3N4;
(2)由方程式,得:6 CO — 12e-,标准状况下4.48 L CO的物质的量为0.2mol,则转移的电子数为:0.2mol×2×NA="0.4" NA;
(3)分析图像,得:反应物总能量>生成物总能量,所以为放热反应;
(三)(1)分析图像,得:N减少,则N为反应物,M增多,则M为生成物;且N未减少到零,到t3后保持一定值,说明达到了平衡,则N生成M是一个可逆反应:
N
 M
Mn0 8 2
n(平衡) 2 5 ,得:△n(N):△n(M)=6:3=方程式中的化学计量系数之比,
所以:该反应的化学方程式为2N
 M;
M;(2)t2时刻,反应还没有达到平衡状态,且反应在正向进行,故
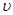 (正)>
(正)>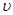 (逆);
(逆);(3)
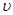 (M)=[(4-2)mol/4L]/2min=0.25mol /(L·min)
(M)=[(4-2)mol/4L]/2min=0.25mol /(L·min)(4)反应物的转化率=(8-2)/8=75%

练习册系列答案
相关题目
 C(g)+3D(g),现从两条途径分别建立平衡,途径Ⅰ:A、B的起始浓度均为2 mol·L—1途径Ⅱ: C、D的起始浓度分别为2 mol·L—1 和6 mol·L—1 ,以下叙述正确的是 ( )
C(g)+3D(g),现从两条途径分别建立平衡,途径Ⅰ:A、B的起始浓度均为2 mol·L—1途径Ⅱ: C、D的起始浓度分别为2 mol·L—1 和6 mol·L—1 ,以下叙述正确的是 ( ) pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )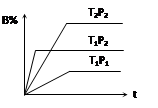
 2B(g)和2C(g)
2B(g)和2C(g)  nC(g) +2D(g),经过5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min).
nC(g) +2D(g),经过5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min). 2AB(g)达到化学平衡状态的标志是( )
2AB(g)达到化学平衡状态的标志是( ) 2NO2(g),△H<0体系中,n(NO)随时间的变化如表:
2NO2(g),△H<0体系中,n(NO)随时间的变化如表: (2)右图中表示NO2浓度的变化的曲线是 。
(2)右图中表示NO2浓度的变化的曲线是 。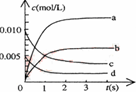
 2HI(g)已经达到平衡状态的标志 (填序号)。
2HI(g)已经达到平衡状态的标志 (填序号)。 C(g)+D(g) 已达平衡的是
C(g)+D(g) 已达平衡的是