题目内容
【题目】氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1molH-H 键,1molN-H键, 1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应合成NH3的热化学方程式为___________________________________。
(2)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),下列说法能说明上述反应达到平衡的是___________(填序号)。
2NH3(g),下列说法能说明上述反应达到平衡的是___________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成n mol N≡N键
③N2、H2、NH3的物质的量浓度之比为1∶3∶2
④混合气体的平均摩尔质量不变。
⑤容器内的气体密度不变
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g) ![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
C(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①升高温度时,气体颜色加深,则正反应是_________(填“放热”或“吸热”)反应。
②该温度下反应的化学平衡常数数值为_____________。
③相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后: c(NO2) ______ 0.60mol·L-1(填“>”、 “=”或“<”)
(4)N2O5是一种新型硝化剂,其性质和制备受人们关注。现以 H2、O2、熔融盐 Z(Na2CO3)组成的燃料电池电解制备N2O5,装置如图所示,其中Y为CO2。
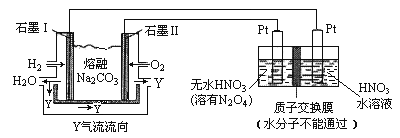
①写出石墨I电极上发生反应的电极反应式 _______________________________________;
②在电解池中生成N2O5的电极反应式为_______________________________________
【答案】N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1 ①②④ 吸热 1.8 < H2+CO32--2e-=CO2+H2O N2O4+2HNO3-2e-=2N2O5+2H+
【解析】
(1)由H=反应物总能量-生成物总能量,可知![]() 与
与![]() 反应合成
反应合成![]() 的热化学方程式;
的热化学方程式;
(2)化学反应平衡的两大标志为“等”,“定”, “等”正逆反应速率相等(可解读为1.反应物的消耗量和生成物的消耗量等于反应系数比;2.反应物断键和生成物断键或反应物成键和生成物成键数目为一定比例),“定”指反应中变化的量不在变化;
(3)反应中四氧化二氮为无色气体,二氧化氮为红棕色气体,升高温度时,气体颜色加深,可以得知反应向生成二氧化氮的方向移动,将勒夏特列原理可以得知反应为放热;
(4)装置中左侧为熔融碳酸盐做电解质的燃料电池装置为右侧的装置提供外部电源,右侧工作原理为电解池原理;
(1)拆开1molH-H键,1moLN-H键,1moN≡N键分别需要的能量是436kJ、391kJ、946kJ,化学方程式为![]() ,依据化学方程式计算反应热为△H=946kJ/mol+3×436kJ/mol+6×391kJ/mol=-92KJ/mol,故反应的热化学方程式为:
,依据化学方程式计算反应热为△H=946kJ/mol+3×436kJ/mol+6×391kJ/mol=-92KJ/mol,故反应的热化学方程式为:![]() ,△H=-92KJ/mol;
,△H=-92KJ/mol;
(2)①单位时间内生成2n mol![]() 的同时消耗3nmol
的同时消耗3nmol![]() ,于此同时生成3n mol
,于此同时生成3n mol![]() ,故可知①可以作为达成平衡的标志;
,故可知①可以作为达成平衡的标志;
②单位时间内生成6n mol ![]() 键的同时消耗nmol
键的同时消耗nmol![]() ,此时生成n mol
,此时生成n mol![]() 键故②可以作为达成平衡的标志;
键故②可以作为达成平衡的标志;
③![]() 的物质的量浓度之比为1∶3∶2,并不能说明物质的量浓度不变,故③不能作为达成平衡的标志;
的物质的量浓度之比为1∶3∶2,并不能说明物质的量浓度不变,故③不能作为达成平衡的标志;
④![]() ,由反应式可知质量为定值,
,由反应式可知质量为定值,![]() 为变化的值,故
为变化的值,故![]() 不变可以作为达成平衡的标志;
不变可以作为达成平衡的标志;
⑤容器内的气体密度![]() ,
,![]() 为定值,
为定值,![]() 为定值,故容器内的气体密度不变不能作为达成平衡的标志;
为定值,故容器内的气体密度不变不能作为达成平衡的标志;
选①②④;
(3)①2对于![]() ,反应中四氧化二氮为无色气体,二氧化氮为红棕色气体,升高温度时,气体颜色加深,说明平衡正向进行,则正反应为吸热反应;
,反应中四氧化二氮为无色气体,二氧化氮为红棕色气体,升高温度时,气体颜色加深,说明平衡正向进行,则正反应为吸热反应;
②.该温度下2L密闭容器中充入0.40mol![]() 结合三段式得到
结合三段式得到
![]()
起始量(mo/L) 0.2 0
变化量(mo/L) 0.15 0.3
平衡量(mol/L) 0.05 0.3
平衡常数K= ![]() =
=![]() =1.8;
=1.8;
③. ![]()
起始量(mol) 0.4 0
全部转化 0 0.8
则相同温度下,若开始向该容器中充入0.80mol![]() ,则达到平衡后和充入0.4mol四氧化二氮达到相同的平衡状态,故c(NO2)=0.3mol/L,所以 c(NO2)小于 0.60mol·L-1;
,则达到平衡后和充入0.4mol四氧化二氮达到相同的平衡状态,故c(NO2)=0.3mol/L,所以 c(NO2)小于 0.60mol·L-1;
(4).①燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,故电极反应式为:H2+CO32--2e-=CO2+H2O;②![]() 中氮元素的化合价是+5价,而硝酸中氮元素也是+5价,因此应该在左侧生成
中氮元素的化合价是+5价,而硝酸中氮元素也是+5价,因此应该在左侧生成![]() ,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为:N2O4+2HNO3-2e-=2N2O5+2H+。
,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为:N2O4+2HNO3-2e-=2N2O5+2H+。

 阅读快车系列答案
阅读快车系列答案【题目】从下列事实所得出的解释或结论正确的是
选项 | 实验事实 | 解释或结论 |
A | 已知 | 金刚石比石墨稳定 |
B |
| 这是一个熵增反应 |
C | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的转化率一定增大 |
D | 用醋酸作导电性实验时,灯泡很暗 | 说明醋酸是弱酸 |
A.AB.BC.CD.D
【题目】常温下,浓度均为0.1 molL-1的4种钠盐溶液pH如下:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中不正确的是
A. 四种溶液中,Na2CO3溶液中水的电离程度最大
B. 向氯水中加入NaHCO3(s),可以增大氯水中次氯酸的浓度
C. NaHSO3溶液显酸性的原因是:NaHSO3=Na++H++SO32-
D. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3