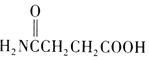题目内容
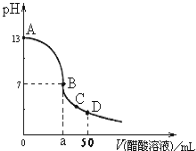
【题目】常温下,H2SO3的电离常数:Ka1=1.54×10-2,Ka2=1×10-7.向m mL0.1mo1L-1H2SO3溶液中滴加0.1molL-1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示,下列说法正确的是( )
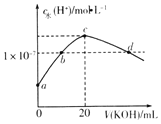
A.m=20
B.c点对应的溶液中存在c(K+)=c(HSO3-)+2c(SO32-)
C.b、d两点溶液的pH=7
D.SO32-+H2OHSO3-+OH-的Kb=1×10-7
【答案】D
【解析】
A.mmL0.1mol/LH2S溶液中滴加0.1mol/LKOH溶液20mL,恰好反应生成K2S,溶液显碱性,消耗H2S体积m=10mL,故A错误;
B.c点时水的电离程度最大,K2S水解促进水的电离,c点恰好反应生成K2S,此时溶液为碱性,溶液中存在电荷守恒:c(K+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),由于c(H+)<c(OH-),则c(K+)>c(HSO3-)+2c(SO32-),故B错误;
C.b、d点水电离出氢离子1×10-7mol/L,b点为中性溶液,所以b点pH=7,d点为硫化钾和氢氧化钾的混合液,溶液显碱性,pH>7,故C错误;
D.常温下,SO32-+H2OHSO3-+OH--的Kb=![]() =1×10-7,故D正确,
=1×10-7,故D正确,
故选:D。

【题目】氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1molH-H 键,1molN-H键, 1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应合成NH3的热化学方程式为___________________________________。
(2)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),下列说法能说明上述反应达到平衡的是___________(填序号)。
2NH3(g),下列说法能说明上述反应达到平衡的是___________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成n mol N≡N键
③N2、H2、NH3的物质的量浓度之比为1∶3∶2
④混合气体的平均摩尔质量不变。
⑤容器内的气体密度不变
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g) ![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
C(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①升高温度时,气体颜色加深,则正反应是_________(填“放热”或“吸热”)反应。
②该温度下反应的化学平衡常数数值为_____________。
③相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后: c(NO2) ______ 0.60mol·L-1(填“>”、 “=”或“<”)
(4)N2O5是一种新型硝化剂,其性质和制备受人们关注。现以 H2、O2、熔融盐 Z(Na2CO3)组成的燃料电池电解制备N2O5,装置如图所示,其中Y为CO2。
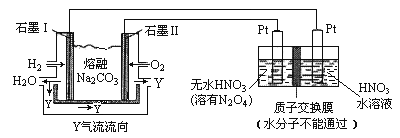
①写出石墨I电极上发生反应的电极反应式 _______________________________________;
②在电解池中生成N2O5的电极反应式为_______________________________________