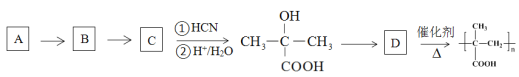
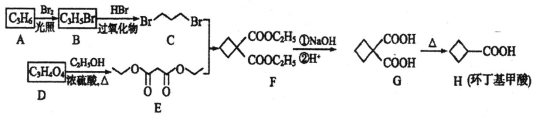
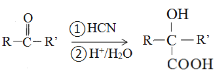题目内容
【题目】从废旧锂离子二次电池(主要成分为![]() ,还含有少量石墨和金属钢売、铝箔等杂质)中回收钴和锂的工艺流程如下:回答下列问题:
,还含有少量石墨和金属钢売、铝箔等杂质)中回收钴和锂的工艺流程如下:回答下列问题:

(1)![]() 的电子式为__________。“碱浸”的目的是____________。
的电子式为__________。“碱浸”的目的是____________。
(2)“酸浸”过程中![]() 发生反应的离子方程式为______________,浸渣中含有的主要成分是_______________________。
发生反应的离子方程式为______________,浸渣中含有的主要成分是_______________________。
(3)“萃取净化”除去的杂质离子除![]() 外,还有________(填离子符号)
外,还有________(填离子符号)
(4)“苯取分离“中钴、锂的萃取率与平衡时溶液![]() 的关系如图所示,
的关系如图所示,![]() 一般选择5左右,理由是_____________________________________。
一般选择5左右,理由是_____________________________________。

(5)“沉锂“中![]() 的溶解度随温度变化的曲线如图所示:
的溶解度随温度变化的曲线如图所示:
①根据平衡原理分析![]() 在水中的溶解度随温度变化的原因______________。
在水中的溶解度随温度变化的原因______________。
②为获得高纯![]() ,提纯操作依次为热过滤、_______、烘干。
,提纯操作依次为热过滤、_______、烘干。
③若“沉锂”中![]() ,加入等体积等浓度
,加入等体积等浓度![]() 溶液,则此时沉锂率为________________。(已知
溶液,则此时沉锂率为________________。(已知![]() 的
的![]() 为
为![]() )
)
【答案】![]() 除去铝
除去铝 ![]() 石墨
石墨 ![]()
![]() 在5左右时钴、锂的分离效率最高
在5左右时钴、锂的分离效率最高 ![]() 溶解过程为放热反应,温度升高,溶解度减少 洗涤 88.0%
溶解过程为放热反应,温度升高,溶解度减少 洗涤 88.0%
【解析】
废旧锂离子二次电池含有LiCoO2、少量石墨和镀镍金属钢壳、铝箔以及钙,加入氢氧化钠溶液除去铝。碱浸后的固体中加入硫酸和双氧水与LiCoO2反应生成Li2SO4和COSO4,硫酸与金属钢壳反应,会有少量二价亚铁离子的生成,在双氧水的作用下,转化为三价铁离子,分离出浸渣。滤液中加入萃取剂A,除去Ni2+、Fe3+。“萃取净化”后的溶液中加入萃取剂B,“苯取分离“钴和锂,有机相中加入硫酸反萃取,生成CoSO4,水溶液中加入Na2CO3生成Li2CO3沉淀,据此分析解答。
(1)![]() 为离子化合物,电子式为
为离子化合物,电子式为![]() ;废旧锂离子二次电池含有LiCoO2、少量石墨和镀镍金属钢壳、铝箔等,加入氢氧化钠溶液,只有铝与其反应,其他成分不反应,故目的是除去铝。
;废旧锂离子二次电池含有LiCoO2、少量石墨和镀镍金属钢壳、铝箔等,加入氢氧化钠溶液,只有铝与其反应,其他成分不反应,故目的是除去铝。
因此,本题正确答案是:![]() ;除去铝;
;除去铝;
(2)LiCoO2中钴显+3价,从后面可以看出钴显+2价,除加入硫酸和双氧水外,没有加入还原剂了,所以双氧水作还原剂,生成氧气,故离子方程式为![]() ;石墨不溶解,存在于滤渣中。
;石墨不溶解,存在于滤渣中。
因此,本题正确答案是:![]() ;石墨;
;石墨;
(3)二次电池中含有镀镍金属钢壳,加入硫酸,会有少量二价亚铁离子的生成,在双氧水的作用下,转化为三价铁离子,存在于滤液中,故加入萃取液A,净化时,除了镍离子外,还有少量的铁离子。
因此,本题正确答案是:![]() ;
;
(4)由图可知,pH值2~5,随pH值的增加,萃取率在增加,当pH达到5左右,萃取率很高,接近100%,而若pH值再增加,萃取锂的含量将增加,萃取钴纯度下降,故pH一般选择5左右进行萃取实验,使分离效率最高。
因此,本题正确答案是:![]() 在5左右时钴、锂的分离效率最高;
在5左右时钴、锂的分离效率最高;
(5)①由图可知,溶解度随温度的升高而降低,根据平衡移动的原理,温度升高,平衡向吸热方向进行,故此溶解为放热过程。
因此,本题正确答案是:![]() 溶解过程为放热反应,温度升高,溶解度减少;
溶解过程为放热反应,温度升高,溶解度减少;
② 对物质进行提纯,在过滤和烘干之间,必须洗涤,以保证得到物质纯度较高。
因此,本题正确答案是:洗涤;
③加入等体积等浓度Na2CO3溶液,加入后体积变为原来的两倍,故浓度变为原来的一半,即c(Li+)=c(CO32-)=0.5mol/L,2Li++CO32-=Li2CO3,故碳酸根过量,反应后c(CO32-)=0.25mol/L,根据![]() 为
为![]() ,从而求得c(Li+)=0.06mol/L,故沉锂率为
,从而求得c(Li+)=0.06mol/L,故沉锂率为![]() 100%=88.0%。
100%=88.0%。
因此,本题正确答案是:88.0%。

【题目】中国科学院大连化学物理研究所的“甲醇制取低碳烯经(![]() 技术”获得国家科学技术发明一等奖,该技术先由煤气化制合成气再由合成气制甲醇和氨气,最后由甲醇制乙烯和丙烯。
技术”获得国家科学技术发明一等奖,该技术先由煤气化制合成气再由合成气制甲醇和氨气,最后由甲醇制乙烯和丙烯。
(1)煤气化包含一系列化学反应,已知热化学方程式:
![]()
![]()
![]()
![]()
则反应![]()
![]() _____
_____![]()
(2)以投料比![]() 合成甲醇:
合成甲醇:![]() ,温度、压强与
,温度、压强与![]() 的平衡转化率的关系如图所示
的平衡转化率的关系如图所示

回答下列问题:
①![]() _____(填>”或“<)0
_____(填>”或“<)0
②![]() ______(填“>“或“<”)
______(填“>“或“<”)![]()
③![]() ,
,![]() 时,
时,![]() 点的
点的![]() _____(填>”或"<")
_____(填>”或"<")![]() 。
。
④若起始时提高投料比![]() 的平衡转化率将_______(填”増大”或“减小”)。
的平衡转化率将_______(填”増大”或“减小”)。
⑤参照下表,实际工业生产中大多采用![]() 和
和![]() ,其优点是____________。
,其优点是____________。
span>方法 | 催化剂 | 条件 | 备注 | 特点 | |
压力 | 温度 | ||||
高压法 |
二元催化剂 | 25~30 | 380~400 | 1924年工业化 | (1)催化剂不易中毒,再生困难 (2)副反应多 |
低压法 |
三元催化剂 | 5 | 230~270 | 1966年工业化 | (1)催化剂易中毒,再生容易,寿命为1~2年 (2)副反应少 |
(3)![]() 和
和![]() 生成
生成![]() 的反应为
的反应为![]()
![]() ,在
,在![]() 催化剂作用下的反应历程如下(
催化剂作用下的反应历程如下(![]() 表示吸附态)
表示吸附态)
化学吸附:![]() ;
;![]()
表面反应![]() ;
;![]() ,
,![]()
脱附:![]()
其中,![]() 的吸附分解反应活化能高,速率慢,决定了合成氨的整体反应速率.
的吸附分解反应活化能高,速率慢,决定了合成氨的整体反应速率.
①有利于提高合成氨平衡产率的条件有______(填字母)
A 低温 B 高温 C 低压 D 高压 E 催化剂
②标准平衡常数![]() =
=![]() ,其中
,其中![]() 为标准压强(
为标准压强(![]() ),
),![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如
为各组分的平衡分压,如![]() ,
,![]() 为平衡总压,
为平衡总压,![]() 为平衡系统中
为平衡系统中![]() 的物质的量分数.已知起始时向一密闭容器中投入
的物质的量分数.已知起始时向一密闭容器中投入![]()
![]() 和
和![]()
![]() ,反应
,反应![]()
![]() +
+![]()
![]()
![]()
![]() 在恒定温度和标准压强下进行,
在恒定温度和标准压强下进行,![]() 的平衡产率为
的平衡产率为![]() ,则该反应的
,则该反应的![]() =________(用含
=________(用含![]() 的代数式表示)。下图中可以表示标准平衡常数随温度
的代数式表示)。下图中可以表示标准平衡常数随温度![]() 的变化趋势的是____________(填字母)
的变化趋势的是____________(填字母)