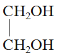题目内容
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2(g) + CO(g)![]() CO2(g) + NO(g)ΔH=-234 kJ/mol该反应的平衡常数为K1(下同)
CO2(g) + NO(g)ΔH=-234 kJ/mol该反应的平衡常数为K1(下同)
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________;
以及此热化学方程式的平衡常数K=________(用K1、K2、K3表示)。
(2)①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是________。
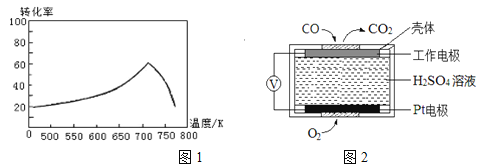
②已知:测定空气中NO和CO含量常用的方法有两种:
方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为____;
方法2:氧化还原滴定法。用H2O2溶液吸收尾气、将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式:________________。
(3)NO2会污染环境,可用Na2CO3溶液吸收NO2 并生成CO2,已知9.2gNO2气体和Na2CO3溶液完全反应时转移电子0.1mol,恰好反应后,使得溶液中的CO2完全逸出,所得溶被呈弱碱性,则溶液中存在的所有离子浓度大小关系是____________________________。
(4)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图I、Ⅱ所示。
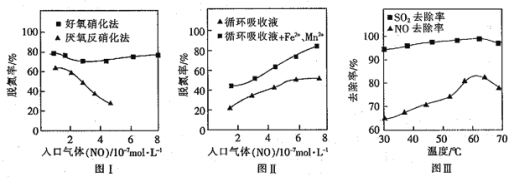
①由图I知,当废气中的NO含量增加时,宜选用___________法提高脱氮的效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为___________。
(5)研究表明:NaClO/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。温度高于60℃后,NO去除率下降的原因为___________。
【答案】2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=-759.8kJ/mol ![]() 温度升高到710 K时,反应达到平衡状态,由于该反应是放热反应,升高温度,平衡逆向移动,氮氧化物转化率降低 CO-2e-+H2O=CO2+2H+ 2NO+3H2O2=2NO3-+2H2O+2H+ c(Na+)>c(NO3-)>c NO2-)>c(OH-)>c(H+) 好氧硝化 Fe2+、Mn2+对该反应有催化作用 温度升高H2O2分解速率加快;
温度升高到710 K时,反应达到平衡状态,由于该反应是放热反应,升高温度,平衡逆向移动,氮氧化物转化率降低 CO-2e-+H2O=CO2+2H+ 2NO+3H2O2=2NO3-+2H2O+2H+ c(Na+)>c(NO3-)>c NO2-)>c(OH-)>c(H+) 好氧硝化 Fe2+、Mn2+对该反应有催化作用 温度升高H2O2分解速率加快;
【解析】
根据NO的化合价变化,从氧化还原反应的角度推断出反应生成物,再根据盐类的水解原理分析溶液中的离子浓度大小;根据图像变化,从影响反应的各方面因素角度分析解答。
(1)将热反应方程式①×2+③-②,可以得到2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=2 K1+ K3- K2=-759.8kJ/mol,总反应方程式是通过反应①×2+③-②的叠加得到总方程,则总方程的平衡常数等于分方程的平衡常数的幂之积,即![]() ;
;
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=-759.8kJ/mol, ![]() ;
;
(2) ①温度低于710K时,反应为达到平衡状态,当温度升高到710 K时,反应达到平衡状态,而此反应是放热反应,升高温度时,平衡向吸热方向移动,即向逆反应方向移动,所以氮氧化物转化率降低;
故答案为:温度升高到710 K时,反应达到平衡状态,由于该反应是放热反应,升高温度,平衡逆向移动,氮氧化物转化率降低;
②该装置是原电池,通入一氧化碳的电极是负极,负极上一氧化碳失电子发生氧化反应,电极反应式为:CO-2e-+H2O═CO2+2H+;
NO被H2O2溶液氧化成强酸硝酸,双氧水被还原成水,则反应的离子方程式2NO+3H2O2═2NO3-+2H2O+2H+;故答案为:CO-2e-+H2O═CO2+2H+;2NO+3H2O2═2NO3-+2H2O+2H+;
(3) 9.2gNO2的物质的量为:![]() =0.2mol,Na2CO3溶液完全反应生成CO2时转移电子0.1mol,反应中只有N元素化合价变化,则N的化合价分别由+4价变化为+5价和+3价,反应的离子方程式为:2NO2+CO32-=NO3-+NO2-+CO2,在碱性溶液中应生成NaNO3和NaNO2,二者浓度相等,NO2-水解使溶液呈弱碱性,所得溶液中的离子浓度大小关系为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);
=0.2mol,Na2CO3溶液完全反应生成CO2时转移电子0.1mol,反应中只有N元素化合价变化,则N的化合价分别由+4价变化为+5价和+3价,反应的离子方程式为:2NO2+CO32-=NO3-+NO2-+CO2,在碱性溶液中应生成NaNO3和NaNO2,二者浓度相等,NO2-水解使溶液呈弱碱性,所得溶液中的离子浓度大小关系为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);
故答案为:c(Na+)>c(NO3-)>c NO2-)>c(OH-)>c(H+);
(4) ①从图中观察可知,好氧硝化法收受NO浓度变化影响不大,所以当废气中的NO含量增加时,宜选用好氧硝化法提高脱氮的效率;
故答案为:好氧硝化;
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,是因为Fe2+、Mn2+对该反应有催化作用;
故答案为:Fe2+、Mn2+对该反应有催化作用;
(5)当温度高于60℃后,双氧水受热分解速率加快,致使NO去除率下降;
故答案为:温度升高H2O2分解速率加快。

 阅读快车系列答案
阅读快车系列答案【题目】以![]() 、软锰矿(主要成分为
、软锰矿(主要成分为![]() ,少量
,少量![]() 及
及![]() 的化合物等)、氨水及净化剂等为原料可制备
的化合物等)、氨水及净化剂等为原料可制备![]() 液和
液和![]() ,主要实验步骤如下
,主要实验步骤如下

步骤I、如图所示装置,将![]() 通入
通入![]() 中的软锰矿浆液中
中的软锰矿浆液中![]() 。
。
步骤II、充分反应后,在不断搅拌下依次向仪器![]() 中加入适量纯净的
中加入适量纯净的![]() ,最后加入适量
,最后加入适量![]() 沉铅,
沉铅,
步骤III、过滤得![]() 溶液
溶液
(1)仪器R的名称是_______。
(2)装置![]() 用于制取
用于制取![]() ,反应的化学方程式为_________。
,反应的化学方程式为_________。
(3)装置![]() 中的反应应控制在90~100℃,适宜的加热方式是______________。
中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置![]() 的作用是______________________。
的作用是______________________。
(5)“步骤Ⅱ”中加入纯净![]() 的目的是_______________,用
的目的是_______________,用![]() 调节溶液
调节溶液![]() 时,需调节溶液
时,需调节溶液![]() 的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的
的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的![]() 如下表)
如下表)
金属离子 |
|
|
|
|
开始沉淀的 | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全的 | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化![]() 浊液可制备
浊液可制备![]() ,主要副产物为
,主要副产物为![]() ;反应温度和溶液
;反应温度和溶液![]() 对产品中
对产品中![]() 的质量分数的影响分别如图所示
的质量分数的影响分别如图所示

②反应温度超过![]() 时,
时,![]() 的产率开始降低,
的产率开始降低,![]() 是白色沉淀,
是白色沉淀,![]() 呈黑色;
呈黑色;![]() 、
、![]() 中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到
中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到![]() 溶液,并用氨水等制备较纯净的
溶液,并用氨水等制备较纯净的![]() 的实验方案:______________________,真空干燥6小时得产品
的实验方案:______________________,真空干燥6小时得产品![]() 。
。