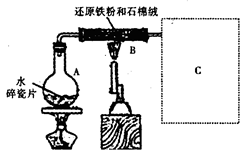
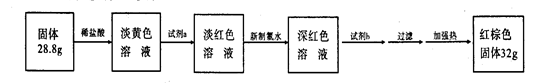
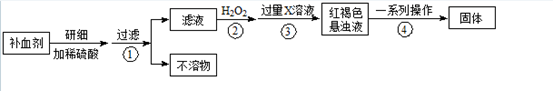
题目内容
ag铁粉与含有H2SO4的CuSO4溶液完全反应后,固体质量与反应前相同, 则
参加反应的CuSO4与H2SO4的物质的量之比为
参加反应的CuSO4与H2SO4的物质的量之比为
| A.1 :7 | B.7 :1 | C.7 :8 | D.8 :7 |
B
试题分析:设铁的物质的量是x,消耗的硫酸的物质的量是y,
Fe先与CuSO4反应,再与H2SO4反应,
因为a/56 > a/64,所以CuSO4反应完全, 剩余Fe与H2SO4反应,
则由定量关系得:
Fe----Cu
x (a/64)mol
则x=(a/64)mol
Fe-------------------H2SO4
(a/56-a/64)mol y
则y=(a/56-a/64)mol
所以
n(CuSO4):n(H2SO4)=x:y=(a/64):(a/56-a/64) =7:1。
故选B。
点评:此题要特别注意过量和不足的问题,计算之前就要根据条件作出判断。

练习册系列答案
相关题目