题目内容
(14分)铁是一种过渡元素,金属铁是最常用的金属。请回答下列各题:
(1)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为 。上述反应生成的磁性固体能溶于过量盐酸,该反应的离子方程式为 。
(2)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(3)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制绿矾。利用烧渣制绿矾的过程如下:

①烧渣溶于稀H2SO4过程中,有单质硫生成,写出该反应的离子方程式(只写生成S的反应式,其他反应无需写出) 。
②向溶液X中加入足量铁屑的目的是 。
③可用硫酸酸化的 KMnO4溶液通过滴定法测定绿矾产品中FeSO4含量,滴定时发生反应的离子方程式为 。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,通过计算说明Fe3+是否沉淀完全 。
(提示:当某离子浓度小于1.0×10-5 mol?L-1时可以认为该离子沉淀完全了)
(1)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为 。上述反应生成的磁性固体能溶于过量盐酸,该反应的离子方程式为 。
(2)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(3)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制绿矾。利用烧渣制绿矾的过程如下:

①烧渣溶于稀H2SO4过程中,有单质硫生成,写出该反应的离子方程式(只写生成S的反应式,其他反应无需写出) 。
②向溶液X中加入足量铁屑的目的是 。
③可用硫酸酸化的 KMnO4溶液通过滴定法测定绿矾产品中FeSO4含量,滴定时发生反应的离子方程式为 。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,通过计算说明Fe3+是否沉淀完全 。
(提示:当某离子浓度小于1.0×10-5 mol?L-1时可以认为该离子沉淀完全了)
(1)Fe3C + 3O2 Fe3O4 + CO2(2分) Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O(2分)
Fe3O4 + CO2(2分) Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O(2分)
(2)2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+(2分)
(3)①2Fe3+ + H2S = 2Fe2+ + S↓ + 2H+(2分)
②使Fe3+完全转化为Fe2+,以制备纯净的绿矾晶体(2分)
③5Fe2+ + MnO4- + 8H+ = 5Fe3++Mn2+ + 4H2O(2分)
(4)计算得c(Fe3+)=1.1×10-3mol?L-1>1×10-5 mol?L-1,故Fe3+没有沉淀完全(2分)
 Fe3O4 + CO2(2分) Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O(2分)
Fe3O4 + CO2(2分) Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O(2分)(2)2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+(2分)
(3)①2Fe3+ + H2S = 2Fe2+ + S↓ + 2H+(2分)
②使Fe3+完全转化为Fe2+,以制备纯净的绿矾晶体(2分)
③5Fe2+ + MnO4- + 8H+ = 5Fe3++Mn2+ + 4H2O(2分)
(4)计算得c(Fe3+)=1.1×10-3mol?L-1>1×10-5 mol?L-1,故Fe3+没有沉淀完全(2分)
(1)根据反应物和生成物可知,反应的方程式为Fe3C + 3O2 Fe3O4 + CO2。由于四氧化三铁中铁元素的化合价既有+2价的,还有+3价的,所以方程式为Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O。
Fe3O4 + CO2。由于四氧化三铁中铁元素的化合价既有+2价的,还有+3价的,所以方程式为Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O。
(2)根据题意,总反应式减去4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O即得到另一个,即2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+。
(3)①在反应中硫化亚铁和硫酸反应生成硫化氢,而氧化铁和硫酸反应生成硫酸铁,硫酸铁能氧化硫化氢生成硫单质,方程式为2Fe3+ + H2S = 2Fe2+ + S↓ + 2H+。
②溶液中含有铁离子,所以必须其还原成亚铁离子,即铁粉的作用是使Fe3+完全转化为Fe2+,以制备纯净的绿矾晶体。
③高锰酸钾溶液具有氧化性,能把硫酸亚铁氧化生成硫酸铁,方程式为5Fe2+ + MnO4- + 8H+ = 5Fe3++Mn2+ + 4H2O。
(4)pH=3,所以溶液中OH-的浓度是10-11mol/L,所以根据溶度积常数的表达式
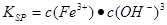 可知,溶液中铁离子浓度是
可知,溶液中铁离子浓度是 >1×10-5 mol?L-1,故Fe3+没有沉淀完全。
>1×10-5 mol?L-1,故Fe3+没有沉淀完全。
 Fe3O4 + CO2。由于四氧化三铁中铁元素的化合价既有+2价的,还有+3价的,所以方程式为Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O。
Fe3O4 + CO2。由于四氧化三铁中铁元素的化合价既有+2价的,还有+3价的,所以方程式为Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O。(2)根据题意,总反应式减去4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O即得到另一个,即2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+。
(3)①在反应中硫化亚铁和硫酸反应生成硫化氢,而氧化铁和硫酸反应生成硫酸铁,硫酸铁能氧化硫化氢生成硫单质,方程式为2Fe3+ + H2S = 2Fe2+ + S↓ + 2H+。
②溶液中含有铁离子,所以必须其还原成亚铁离子,即铁粉的作用是使Fe3+完全转化为Fe2+,以制备纯净的绿矾晶体。
③高锰酸钾溶液具有氧化性,能把硫酸亚铁氧化生成硫酸铁,方程式为5Fe2+ + MnO4- + 8H+ = 5Fe3++Mn2+ + 4H2O。
(4)pH=3,所以溶液中OH-的浓度是10-11mol/L,所以根据溶度积常数的表达式
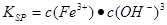 可知,溶液中铁离子浓度是
可知,溶液中铁离子浓度是 >1×10-5 mol?L-1,故Fe3+没有沉淀完全。
>1×10-5 mol?L-1,故Fe3+没有沉淀完全。
练习册系列答案
相关题目
 由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用
由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用 ,
, (稀),NaOH溶液可在还原性气氛中制取
(稀),NaOH溶液可在还原性气氛中制取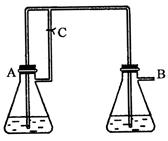
 mL bmol·L
mL bmol·L 的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
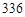 mL气体(标准状况),则b
mL气体(标准状况),则b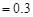
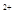 时,则a与b的关系为:b≥
时,则a与b的关系为:b≥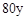 (1
(1 a/3)
a/3)