题目内容
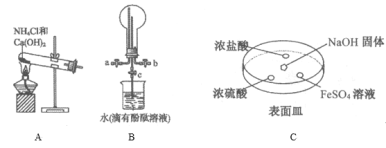
【题目】“将少量氯水加入到NaI溶液中”的学生实验产生了大量含碘废液.某研究小组用该含碘废液制备NaI固体,实验流程如下:
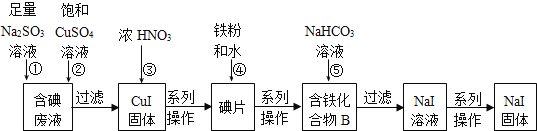
已知:反应②2I-+2Cu2++SO32-+H2O═2CuI↓+SO42-+2H+。回答下列问题:
(1)产生含碘废液的离子方程式为____________。
(2)①中I2与Na2SO3溶液反应的离子方程式为_________。
(3)化合物B中含两种元素,铁元素与另一种元素物质的量之比为3:8,则化合物B的化学式为____。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则⑤的化学方程式为______。
【答案】Cl2+2I-═I2+2Cl- I2+SO32-+H2O═SO42-+2I-+2H+ Fe3I8 Fe3I8+8NaHCO3═Fe3O4+8NaI+8CO2↑+4H2O
【解析】
根据流程中的反应②发生反应:2I-+2Cu2++SO32-+H2O═2CuI↓+SO42-+2H+,过滤则得到碘化亚铜沉淀,碘化亚铜可以被硝酸氧化为碘单质,碘单质中加入铁和水,会得到化合物B,是一种含有铁元素和碘元素的化合物,再向其中加入碳酸氢钠溶液,过滤可以得到碘化钠的溶液,从而制得碘化钠固体;
(1)将少量氯水加入到NaI溶液中,氯气能将碘单质置换出来;
(2)碘单质具有氧化性,亚硫酸根离子具有还原性,I2与Na2SO3溶液发生氧化还原反应;
(3)根据物质中元素的物质的量之比等于原子个数之比来回答;
(4)向碘化铁的溶液中加入碳酸氢钠溶液则生成黑色固体四氧化三铁和二氧化碳无色气体。
(1)将少量氯水加入到NaI溶液中,氯气能将碘单质置换出来,发生的反应为:Cl2+2I-═I2+2Cl-;
(2)碘单质具有氧化性,亚硫酸根离子具有还原性,I2与Na2SO3溶液发生氧化还原反应,即I2+SO32-+H2O═SO42-+2I-+2H+;
(3)化合物B,是一种含有铁元素和碘元素的化合物,铁元素与碘元素物质的量之比为3:8,则化合物B的化学式为Fe3I8;
(4)向碘化铁的溶液中加入碳酸氢钠溶液则生成黑色固体四氧化三铁和二氧化碳无色气体,发生的反应为:Fe3I8+8NaHCO3═Fe3O4+8NaI+8CO2↑+4H2O。

 阅读快车系列答案
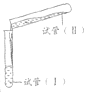
阅读快车系列答案【题目】某学习小组学习了亚铁盐的性质后,欲探究FeSO4溶液分别与Na2CO3溶液、NaHCO3溶液的反应。已知:Fe(OH)2和FeCO3均为白色沉淀,不存在Fe(HCO3)2。实验操作及现象记录如下:
实验 | 试剂 | 操作及现象 | ||
试管(I) | 试管(II) | |||
(试管容积为50 mL) | 实验a | 1.0 mol·L-1 FeSO4溶液 24 mL | 1.0 mol·L-1 Na2CO3溶液24mL | 倾倒完后,迅速用胶塞塞紧试管I的口部,反复上下颠倒摇匀,使反应物充分混合 反应过程中无气泡产生,生成白色絮状沉淀 放置1.5~2 h后,白色絮状沉淀转化为白色颗粒状沉淀 |
实验b | 1.0 mol·L-1 FeSO4溶液 10 mL | 1.0 mol·L-1 NaHCO3溶液 20 mL | 倾倒完后,迅速产生白色颗粒状沉淀和大量气泡。振荡,经2~4 min后液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色 | |
(1)甲同学认为实验a中白色颗粒状沉淀是FeCO3,写出该反应的离子方程式:________;他为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入________,发现产生大量气泡。
(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有Fe(OH)2,他将实验a中两种溶液体积均改成15 mL后再进行实验,证实了他的推测。能证明Fe(OH)2存在的实验现象是_________。
(3)实验b中白色颗粒状沉淀主要成分也为FeCO3,写出生成FeCO3的离子方程式:________。
(4)实验b中液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色,主要原因是潮湿的FeCO3被氧气氧化,写出该反应的化学方程式:__________。
(5)乙同学反思,实验a中含有Fe(OH)2,实验b中几乎不含有Fe(OH)2,对比分析出现差异的原因是_________。