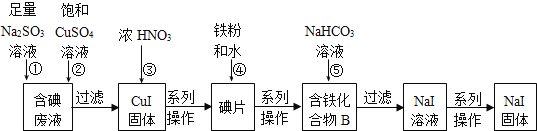
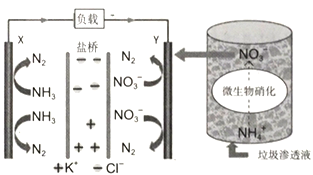
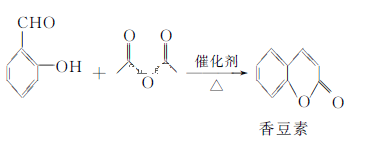
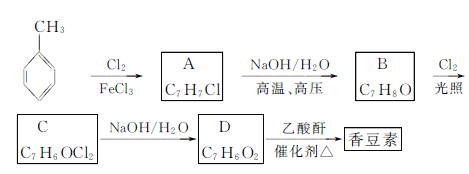
题目内容
【题目】根据阿伏伽德罗常数回答下列问题
(1)在0.5mol CO2中含___个O原子,含___个e-。
(2)同温同压下,同质量的氨气和硫化氢气体体积比为____,其中含有的氢原子数目比为____。
(3)___mol H2SO4分子与1.806×1024个H2O分子含有相同的氧原子数?
(4)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为___,R的相对原子质量为___。
【答案】NA 11NA 2:1 3:1 0.75 62g/mol 16
【解析】
利用n=![]() =
=![]() 进行计算。
进行计算。
(1)一个分子中含有2个O原子,22个电子,则0.5mol时含有1mol O原子,11mol e-;
(2)氨气和硫化氢的摩尔质量分别为17g/mol、34g/mol,同温同压下,同质量的氨气和硫化氢气的物质的量之比为![]() :
:![]() =2:1,相同条件下,物质的量之比等于体积之比,则体积之比为2:1;每个分子中分别含有3、2个氢原子,则氢原子的物质的量之比为2×3:1×2=3:1;
=2:1,相同条件下,物质的量之比等于体积之比,则体积之比为2:1;每个分子中分别含有3、2个氢原子,则氢原子的物质的量之比为2×3:1×2=3:1;
(3)1.806×1024个H2O分子含有的氧原子物质的量=![]() =3mol,氧原子的物质的量与硫酸中的相同,则硫酸的物质的量=
=3mol,氧原子的物质的量与硫酸中的相同,则硫酸的物质的量=![]() =0.75mol;
=0.75mol;
(4)12.4g Na2R含Na+ 0.4mol,则含有Na2R0.2mol,则M=![]() =
=![]() =62g/mol;即Na2R的式量为62,R的原子量=62-23×2=16。
=62g/mol;即Na2R的式量为62,R的原子量=62-23×2=16。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目