题目内容
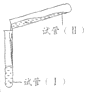
【题目】某学习小组学习了亚铁盐的性质后,欲探究FeSO4溶液分别与Na2CO3溶液、NaHCO3溶液的反应。已知:Fe(OH)2和FeCO3均为白色沉淀,不存在Fe(HCO3)2。实验操作及现象记录如下:
实验 | 试剂 | 操作及现象 | ||
试管(I) | 试管(II) | |||
(试管容积为50 mL) | 实验a | 1.0 mol·L-1 FeSO4溶液 24 mL | 1.0 mol·L-1 Na2CO3溶液24mL | 倾倒完后,迅速用胶塞塞紧试管I的口部,反复上下颠倒摇匀,使反应物充分混合 反应过程中无气泡产生,生成白色絮状沉淀 放置1.5~2 h后,白色絮状沉淀转化为白色颗粒状沉淀 |
实验b | 1.0 mol·L-1 FeSO4溶液 10 mL | 1.0 mol·L-1 NaHCO3溶液 20 mL | 倾倒完后,迅速产生白色颗粒状沉淀和大量气泡。振荡,经2~4 min后液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色 | |
(1)甲同学认为实验a中白色颗粒状沉淀是FeCO3,写出该反应的离子方程式:________;他为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入________,发现产生大量气泡。
(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有Fe(OH)2,他将实验a中两种溶液体积均改成15 mL后再进行实验,证实了他的推测。能证明Fe(OH)2存在的实验现象是_________。
(3)实验b中白色颗粒状沉淀主要成分也为FeCO3,写出生成FeCO3的离子方程式:________。
(4)实验b中液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色,主要原因是潮湿的FeCO3被氧气氧化,写出该反应的化学方程式:__________。
(5)乙同学反思,实验a中含有Fe(OH)2,实验b中几乎不含有Fe(OH)2,对比分析出现差异的原因是_________。
【答案】Fe2+ + CO32- = FeCO3↓ 稀硫酸(或稀盐酸等,合理答案均可得分) 沉淀颜色由白色变为灰绿色,最终变为红褐色 Fe2+ + 2HCO3- = FeCO3↓+ CO2↑+ H2O 4FeCO3 + O2 + 6H2O = 4Fe(OH)3 + 4CO2 混合以后,虽然实验b中c(NaHCO3)比实验a中c(Na2CO3)大,但Na2CO3溶液的碱性(或水解程度)比NaHCO3溶液的强
【解析】
解答本题主要抓住Fe(OH)2和FeCO3的区别进行分析,FeCO3能与酸反应产生气体;能被空气中的氧气氧化为红褐色的氢氧化铁,据此分析解答。
(1)实验a中FeSO4与Na2CO3溶液混合若生成的沉淀是FeCO3,则发生复分解反应,反应的离子方程式为:Fe2+ + CO32- = FeCO3↓;FeCO3溶于硫酸或盐酸产生二氧化碳气体,而氢氧化亚铁与硫酸或盐酸反应不会产生气体,则可用稀硫酸或盐酸来鉴别碳酸亚铁和氢氧化亚铁沉淀,
故答案为:Fe2+ + CO32- = FeCO3↓;稀硫酸(或稀盐酸);
(2)若沉淀中有Fe(OH)2,放置在空气中会被氧化而呈现白色沉淀迅速变成灰绿色,最终变成红褐色的现象,
故答案为:沉淀颜色由白色变为灰绿色,最终变为红褐色;
(3)实验b中的反应物为硫酸亚铁和碳酸氢钠,两者反应除了生成碳酸亚铁沉淀,还有二氧化碳气体和水生成,反应的离子方程式为:Fe2+ + 2HCO3- = FeCO3↓+ CO2↑+ H2O,
故答案为:Fe2+ + 2HCO3- = FeCO3↓+ CO2↑+ H2O;
(4) FeCO3被氧气氧化生成红褐色的氢氧化铁,反应中氧气为氧化剂,碳酸亚铁为还原剂,由氧化还原反应规律可得反应的化学方程式为:4FeCO3 + O2 + 6H2O = 4Fe(OH)3 + 4CO2,
故答案为:4FeCO3 + O2 + 6H2O = 4Fe(OH)3 + 4CO2;
(5) 对比实验a、b,不同之处在于前者反应物为碳酸钠溶液,后者为碳酸氢钠溶液,由于碳酸根离子的水解程度较碳酸根离子的水解大,实验a中混合溶液氢氧根离子浓度较实验b中要大,导致实验a中更易产生Fe(OH)2沉淀,
故答案为:混合以后,虽然实验b中c(NaHCO3)比实验a中c(Na2CO3)大,但Na2CO3溶液的碱性(或水解程度)比NaHCO3溶液的强。