题目内容
【题目】氨气在工农业生产中有重要应用。
(1)氨的催化氧化是工业生产硝酸的基础,写出该化学方程式_________。
(2)某化学实验小组同学利用以下装置制备氨,并探究氨的性质(部分仪器已略去)。
请回答:
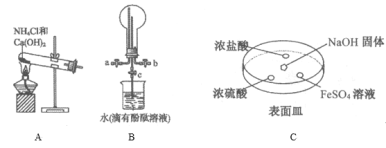
①用装置B收集氨时,氨的进气口是__(选填“a”或“b”)。打开装置B中的活塞c,若观察到烧瓶内产生了红色喷泉,则说明氨具有的性质是______,______。
②向C中NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。浓盐酸液滴附近会出现 _____,(填现象)发生反应的化学方程式为_______。FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O===Fe(OH)2↓+2NH4+和_________。
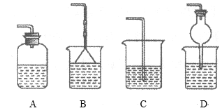
③为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨的__(填序号)。
【答案】4NH3+5O2![]() 4NO+6H2O a 极易溶于水 溶于水形成的溶液呈碱性 白烟 NH3+HCl=NH4Cl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 BD
4NO+6H2O a 极易溶于水 溶于水形成的溶液呈碱性 白烟 NH3+HCl=NH4Cl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 BD
【解析】
(1)氨的催化氧化生成NO和水;
(2)①根据氨气的水溶性和氨气的密度来确定氨气收集方法-向下排空气法;氨气极易溶与水,能产生喷泉现象,溶于水的氨气反应生成一水合氨,一水合氨是弱碱,电离产生氢氧根离子,具有碱性;
②浓盐酸和浓氨水易挥发,浓盐酸液滴附近会出现白烟,发生HCl与氨气的反应生成氯化铵;氨气与硫酸亚铁溶液反应生成氢氧化亚铁,氢氧化亚铁不稳定,易被氧化生成氢氧化铁,以此解答;
③氨气极易溶于水,可用水吸收氨气,注意防到吸。
(1)氨催化氧化生成NO和水,发生反应的化学方程式是4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)①因为氨气极易溶于水,只能用排气法收集,又因为氨气的密度小于空气的密度,所以应该选择向下排空气法收集,氨气从a口进入空气从b口排出;能够形成喷泉实验是因为氨气极易溶于水这一物理性质,产生红色喷泉是因为氨气溶于水后与水反应生成弱碱一水合氨具有碱性;
②浓盐酸液滴附近会出现白烟,发生HCl与氨气的反应生成氯化铵,该反应为NH3+HCl═NH4Cl;FeSO4与碱反应生成白色沉淀,发生反应为Fe2++2NH3H2O═Fe(OH)2↓+2NH4+,然后出现灰绿色沉淀,过一段时间后变成红褐色,是因氢氧化亚铁被氧化,发生反应为4Fe(OH)2+O2+2H2O═4Fe(OH)3;
③氨气极易溶于水,可用水吸收氨气,但是应该注意防止倒吸,BD都具有防倒吸功能,可以用来吸收氨气,故答案为:BD。