题目内容
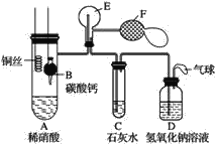
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示,下列说法正确的是( )
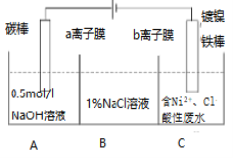
已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.铁棒上发生的电极反应:2H++2e-===H2↑
B.电解过程中,B中NaCl溶液的质量分数将不断增大
C.a膜为阴离子交换膜,b膜为阳离子交换膜
D.若将图中a离子膜去掉,将A、B两室合并,则电解反应总方程式将不发生改变。
【答案】B
【解析】
镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e-=Ni.电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的物质的量浓度不断增大。
A.Fe棒为阴极,表面发生还原反应,则电极反应式为Ni2++2e-=Ni,故A错误;
B.镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e-=Ni.电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的质量分数不断增大,故B正确;
C.电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,故C错误;
D.若将图中阳离子膜去掉,由于放电顺序Cl->OH-,则Cl-移向阳极放电:2Cl--2e-=Cl2↑,电解反应总方程式会发生改变,故D错误;
故答案为B。

【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH
2Fe(s)+3CO2(g) ΔH
(1)已知:① Fe2O3(s)+ 3C(石墨)=2Fe(s)+3CO(g) ΔH1 ②C(石墨)+CO2(g)=2CO(g) ΔH2,则ΔH=______(用含ΔH1、ΔH2代数式表示)
(2)高炉炼铁反应的平衡常数表达式K=_____________。
(3)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为______。
②下列说法正确的是______。
A. 若容器压强恒定,反应达到平衡状态 B. 若容器内气体密度恒定,反应达平衡
C. 甲容器中CO的平衡转化率大于乙的 D. 增加Fe2O3就能提高CO的转化率