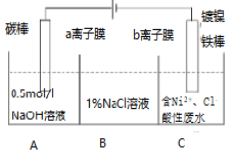
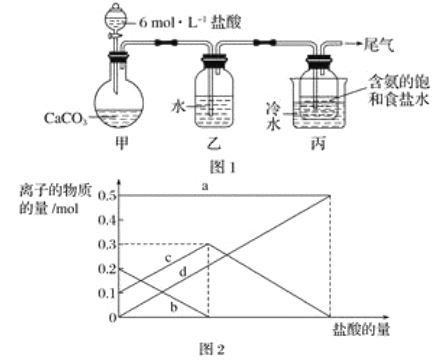
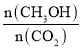题目内容
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH
2Fe(s)+3CO2(g) ΔH
(1)已知:① Fe2O3(s)+ 3C(石墨)=2Fe(s)+3CO(g) ΔH1 ②C(石墨)+CO2(g)=2CO(g) ΔH2,则ΔH=______(用含ΔH1、ΔH2代数式表示)
(2)高炉炼铁反应的平衡常数表达式K=_____________。
(3)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为______。
②下列说法正确的是______。
A. 若容器压强恒定,反应达到平衡状态 B. 若容器内气体密度恒定,反应达平衡
C. 甲容器中CO的平衡转化率大于乙的 D. 增加Fe2O3就能提高CO的转化率
【答案】ΔH1-3ΔH2 ![]() 60% B
60% B
【解析】
(1)依据热化学方程式 和盖斯定律计算分析判断;
(2)Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) △H,依据平衡常数概念写出表达式;
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,依据平衡三段式列式计算结合转化率概念计算得到;
②根据平衡状态的特征,分析解答。
(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1
②C(石墨)+CO2(g)=2CO(g) △H2
依据盖斯定律①-②×3得到Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) △H=△H1-3△H2,
故答案为:△H1-3△H2;
(2)Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g),平衡常数K=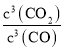 ;
;
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K=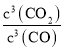 =
=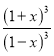 =64,计算得到x=0.6
=64,计算得到x=0.6
转化率=60%
故答案为:60%;
②Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) △H= -28.5kJmol-1
A.若容器压强始终恒定,不能标志反应达到平衡状态,A项错误;
B.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,B项正确;
C.乙容器中结合平衡常数计算得到消耗一氧化碳1mol,乙容器中CO的平衡转化率为66.6%,C项错误;
D.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,D项错误;
故答案为:B。

【题目】饮水安全在灾后重建中具有极其重要的地位,某研究小组提取三处被污染的水源进行了如下分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质、一处含有E物质,A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B__,D__。
(2)将含1molA的溶液与含1molE的溶液充分反应,仅得到一种化合物,该化合物为__。(填化学式)
(3)写出实验②发生反应的离子方程式__。
(4)C常用作净水剂,用离子方程式表示其净水原理__。
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向NaHSO3溶液中滴加足量Ba(OH)2溶液,出现白色沉淀,再加入足量盐酸,沉淀全部溶解 | NaHSO3未被氧化 |
B | 向3mLFe(NO3)3溶液中滴加几滴HI溶液,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | I-的还原性比Fe2+的强 |
C | 向MgSO4、CuSO4的混合稀溶液中滴入1滴稀NaOH溶液,有蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
D | 用精密pH试纸测得:浓度均为0.1mol·L-1的NH4HCO3溶液、HCOONa溶液的pH分别为7.8、10.0 | H2CO3电离出H+的能力比HCOOH的强 |
A.AB.BC.CD.D