题目内容
(12分)已知如图所示的可逆反应:A(g)+B(g) C(g)+D(g) ΔH =" Q" kJ/mol
C(g)+D(g) ΔH =" Q" kJ/mol
请回答下列问题:
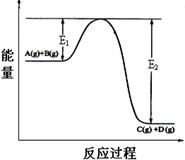
(1)Q 0(填“>”、“<”或“=”);
(2)在某温度下,反应物的起始浓度分别为:c(A)=" 1.0" mol/L,c(B)="2.0" mol/L ;达到平衡后,A的转化率为50%,此时B的转化率为 ;
(3)若反应温度升高,A的转化率 (填“增大”“减小”或“不变”);
(4)若反应温度不变,反应物的起始浓度分别为:c(A)="3.0" mol/L,c(B)=" a" mol/L;达到平衡后,c(D)="1.0" mol/L,则a= ;
(5)反应体系中加入催化剂,反应速率增大,则E1的变化是:E1 (填“增大”“减小”“不变”),ΔH的变化是:ΔH (填“增大”“减小”“不变”)。
 C(g)+D(g) ΔH =" Q" kJ/mol
C(g)+D(g) ΔH =" Q" kJ/mol请回答下列问题:

(1)Q 0(填“>”、“<”或“=”);
(2)在某温度下,反应物的起始浓度分别为:c(A)=" 1.0" mol/L,c(B)="2.0" mol/L ;达到平衡后,A的转化率为50%,此时B的转化率为 ;
(3)若反应温度升高,A的转化率 (填“增大”“减小”或“不变”);
(4)若反应温度不变,反应物的起始浓度分别为:c(A)="3.0" mol/L,c(B)=" a" mol/L;达到平衡后,c(D)="1.0" mol/L,则a= ;
(5)反应体系中加入催化剂,反应速率增大,则E1的变化是:E1 (填“增大”“减小”“不变”),ΔH的变化是:ΔH (填“增大”“减小”“不变”)。
(12分)(12分)(1)< (2分)(2)25%(2分)(3)减小(2分)(4) 2.5 (2分)(5)减小(2分) 不变(2分)
(1)根据图像可知,反应物的总能量大于生成物的总能量,说明是放热反应,即Q<0。
(2)A的转化率为50%,则消耗A是1.0 mol/L×50%=0.5mol/L,所以消耗B也是0.5mol/L,所以B的转化率是0.5mol/L÷2.0mol/L×100%=25%。
(3)正反应是放热反应,升高温度,平衡向逆反应方向移动,A的转化率减小。
(4)达到平衡后,c(D)="1.0" mol/L,则消耗B是1.0 mol/L,由于温度不变,所以平衡常数相同,即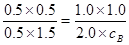 ,解得c(B)=1.5mol/L,所以a=1.5mol/L+1.0mol/L=2.5mol/L。
,解得c(B)=1.5mol/L,所以a=1.5mol/L+1.0mol/L=2.5mol/L。
(5)催化剂能降低活化能,但不能改变反应热。
(2)A的转化率为50%,则消耗A是1.0 mol/L×50%=0.5mol/L,所以消耗B也是0.5mol/L,所以B的转化率是0.5mol/L÷2.0mol/L×100%=25%。
(3)正反应是放热反应,升高温度,平衡向逆反应方向移动,A的转化率减小。
(4)达到平衡后,c(D)="1.0" mol/L,则消耗B是1.0 mol/L,由于温度不变,所以平衡常数相同,即
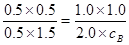 ,解得c(B)=1.5mol/L,所以a=1.5mol/L+1.0mol/L=2.5mol/L。
,解得c(B)=1.5mol/L,所以a=1.5mol/L+1.0mol/L=2.5mol/L。(5)催化剂能降低活化能,但不能改变反应热。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 H2O(l) △H=-57.2 kJ/mol 若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.2 kJ
H2O(l) △H=-57.2 kJ/mol 若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.2 kJ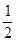 H2(g)+
H2(g)+ C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:  CH4(g)+HC
CH4(g)+HC CH(g)+H2(g) △H1="156.6" kJ·mol-1
CH(g)+H2(g) △H1="156.6" kJ·mol-1 CH2(g)
CH2(g)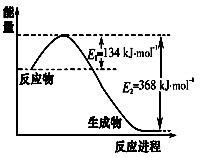
 2NH3(g) △H2=-92.4kJ/mol
2NH3(g) △H2=-92.4kJ/mol