题目内容
下列有关热化学方程式的叙述正确的是
2H2(g)+O2(g) 2H2O(g)△H2 , 则△H1 > △H2
2H2O(g)△H2 , 则△H1 > △H2
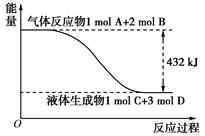
| A.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)==2CO(g)+O2(g)反应的 △H=2×283.0kJ/mol |
C.在稀溶液中H+(aq)+OH-(aq)  H2O(l) △H=-57.2 kJ/mol 若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.2 kJ H2O(l) △H=-57.2 kJ/mol 若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.2 kJ |
D.己知2H2(g)+O2(g) 2H2O(l)△H1 , 2H2O(l)△H1 , |
 2H2O(g)△H2 , 则△H1 > △H2
2H2O(g)△H2 , 则△H1 > △H2B
A不正确,氢气燃烧是放热反应,△H小于0。燃烧热是指在一定条件下,1mol可燃物完全生成稳定的氧化物时所放出的热量,如果正反应是放热反应,则逆反应就是吸热反应,B正确。浓硫酸溶于水放出大量的热,C不正确。由于气态水的能量高于液态水的能量,所以氢气燃烧生成液态水时放热多,但放热越多,△H越小,D不正确,答案选B。

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
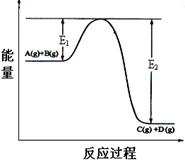
 B+C 在某一温度时达到平衡。
B+C 在某一温度时达到平衡。 O2(g)==H2O(g);△H3,则△H1、△H2和△H3的关系是
O2(g)==H2O(g);△H3,则△H1、△H2和△H3的关系是 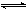 2NH3(g)△H= -38.6kJ·mol-1
2NH3(g)△H= -38.6kJ·mol-1 C(g)+D(g) ΔH =" Q" kJ/mol
C(g)+D(g) ΔH =" Q" kJ/mol