题目内容
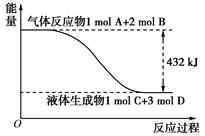
已知0.4 mol液态肼(N2H4)与过量的液态双氧水反应,生成氮气和水蒸气,放出256.65 kJ的热量,该反应的热化学方程式为 。
又已知:H2O(l)=H2O(g) ΔH =+44 kJ/mol,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 。
又已知:H2O(l)=H2O(g) ΔH =+44 kJ/mol,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 。
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.625 kJ/mol ( 3分) 408.813 kJ (2分)
考查热化学方程式的书写。1mol液态肼放出的热量是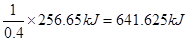 ,所以热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.625 kJ/mol;16g液态肼是0.5mol,生成气态水时放出的热量是0.5mol×641.625 kJ/mol=320.8125kJ,生成的2mol水变成液态又放出88kJ热量,所以最终放出的热量是320.8125kJ+88kJ=408.813 kJ.
,所以热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.625 kJ/mol;16g液态肼是0.5mol,生成气态水时放出的热量是0.5mol×641.625 kJ/mol=320.8125kJ,生成的2mol水变成液态又放出88kJ热量,所以最终放出的热量是320.8125kJ+88kJ=408.813 kJ.
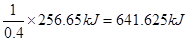 ,所以热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.625 kJ/mol;16g液态肼是0.5mol,生成气态水时放出的热量是0.5mol×641.625 kJ/mol=320.8125kJ,生成的2mol水变成液态又放出88kJ热量,所以最终放出的热量是320.8125kJ+88kJ=408.813 kJ.
,所以热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.625 kJ/mol;16g液态肼是0.5mol,生成气态水时放出的热量是0.5mol×641.625 kJ/mol=320.8125kJ,生成的2mol水变成液态又放出88kJ热量,所以最终放出的热量是320.8125kJ+88kJ=408.813 kJ.
练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
 C(g)+D(g) ΔH =" Q" kJ/mol
C(g)+D(g) ΔH =" Q" kJ/mol