题目内容
【题目】如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
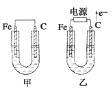
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的____________棒,乙池中的____________棒。
②乙池中阳极的电极反应式是___________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式_________________ 。
②甲池中碳极上电极反应式是_____________________,
③若乙池转移0.02 mol e-后停止实验,溶液体积是200 mL,则溶液混合均匀后的pH=____。
【答案】碳 铁 4OH--4e-=2H2O+O2↑ 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 2H2O+O2+4e-=4OH- 13
Cl2↑+H2↑+2OH- 2H2O+O2+4e-=4OH- 13
【解析】
本题考查的是原电池和电解池的工作原理。
(1)甲池为原电池,乙池为电解池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,发生还原反应;电解池中阳极上发生失电子的氧化反应,阴极发生得电子的还原反应;
(2)①根据电解池的工作原理来书写电解氯化钠的离子方程式;
②甲池为原电池,碳棒做正极,发生还原反应;
③根据电解方程式结合电子转移以及生成氢氧化钠的量的关系来计算氢氧根离子的浓度,从而计算氢离子的浓度,进一步计算pH。
(1)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出,乙池为电解池,外电路电子由电解池阳极流向电源正极,所以碳棒为阳极,放出氧气,阴极铁电极上发生还原反应有Cu析出。本小题答案为:碳;铁。
②乙池中,惰性电极为阳极,电解硫酸铜溶液,阳极氢氧根离子放电生成氧气,电极反应为4OH--4e-=2H2O+O2↑。本小题答案为:4OH--4e-=2H2O+O2↑。
(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极为阳极电解氯化钠溶液,总反应的离子方程式为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。本小题答案为: 2Cl-+2H2O
Cl2↑+H2↑+2OH-。本小题答案为: 2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
②甲池中碳棒为正极,发生还原反应,氧气得到电子生成氢氧根,电极反应式为:O2+2H2O+4e-=4OH-,本小题答案 2H2O+O2+4e-=4OH-。
③电解氯化钠溶液的方程式为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,乙池转移0.02mole-后,会生成0.02mol的氢氧化钠,所得NaOH溶液的物质的量浓度c=n/V=0.02mol÷0.2L=0.1mol/L,c(OH-)=0.1mol/L,则c(H+)=1×10-13mol/L,pH=13,本小题答案为:13。
Cl2↑+H2↑+2NaOH,乙池转移0.02mole-后,会生成0.02mol的氢氧化钠,所得NaOH溶液的物质的量浓度c=n/V=0.02mol÷0.2L=0.1mol/L,c(OH-)=0.1mol/L,则c(H+)=1×10-13mol/L,pH=13,本小题答案为:13。

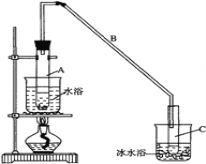
【题目】某化学小组采用如图装置,以环己醇制备环己烯:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
已知: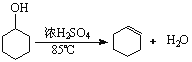
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,
在试管C内得到环己烯粗品。
①试管C置于冰水浴中的目的是 _____________________________________。
②导管B除了导气外还具有的作用是____________,A中碎瓷片的作用是 ___________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在______ 层(填“上”或“下”),分液后用___________________(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是:_________________________。
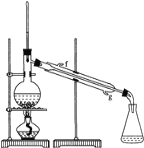
③收集产品时,控制的温度应在________________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 _______
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_______
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点