题目内容
【题目】如图是一块非常独特的手表,用 H~Mg 12 种元素分别表示 1:00~12:00,关于此表的下列说法中不正确的是( )
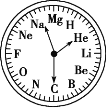
A.2:00 时的时针和 12:00 时的分针所指元素极难形成化合物
B.7:00 时,时针和分针所指元素可能形成相对分子质量为 100 的化合物
C.8:00 时,时针和分针所指元素形成的化合物属于碱性氧化物
D.3:00 时,时针所指元素的金属性比 11:00 时时针所指元素的金属性强
【答案】D
【解析】
A.He为惰性气体元素,与Mg极难形成化合物,故A正确;
B.N、Mg能形成相对分子质量为 100 的化合物Mg3N2,故B正确;
C.O、Mg能形成的化合物MgO,属于碱性氧化物,故C正确;
D.根据元素周期律,Li的金属性比Na的金属性弱,故D错误;
综上所述,答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为________。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为:![]() ,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题:
①前2s内的平均反应速率υ(N2)=____;
②上述条件下,该反应的平衡常数为____;
③上述条件下,测得某时刻反应体系中各物质的物质的量浓度均为0.01mol/L,则此时反应处于___状态。(填“平衡”或“向右进行”或“向左进行”)
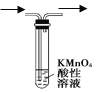
(3)实验室常用0.10mol/L KMnO4标准酸性溶液来测定H2C2O4样品的纯度(标准液滴待测液),其反应原理为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O。
①KMnO4标准液应装在____(填“酸式”或“碱式”)滴定管;
②清水洗净滴定管后直接装入标准液,则测定结果会____;(填“偏大”或“偏小”或“不变”)