题目内容
【题目】I.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A = H+ + HA-,HA-![]() H++A2-。回答下列问题:
H++A2-。回答下列问题:
(1)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系不正确的是_________。
A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(2)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度________(填“>”、“<”或“=”)0.11mol·L-1。
II.亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3![]() H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+) = 2.5×10-2mol·L-1,除OH-之外其他离子的浓度由大到小的顺序是 ,
②写出亚磷酸与少量NaOH溶液反应的离子方程式 。
III.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用。
(1)CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g)![]() CH2==CH2(g)+4H2O(g) △H=a kJ·mol-1 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H=-44.0 kJ·mol-1,则a=______kJ·mol-1。
CH2==CH2(g)+4H2O(g) △H=a kJ·mol-1 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H=-44.0 kJ·mol-1,则a=______kJ·mol-1。
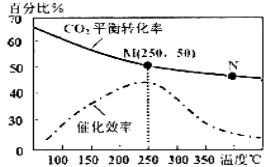
(2)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如右上图,下列有关说法不正确的是_______(填序号)
①温度越高,催化剂的催化效率越高
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随着温度升高,乙烯的产率增大
④增大压强可提高乙烯的体积分数
⑤N点正反应速率一定大于M点正反应速率
IV.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
(3)若在500℃时,投料![]() =1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。
=1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。
【答案】I.(1)A、(2)<;
II.(1)①c(H+)>c(H2PO3-)>c(HPO32-)②H3PO3+OH—=H2PO3—+H2O
III.(1)-127.8;(2)①③⑤;
IV:(3)主要有三种情况:
第一种情况:设c(NO)=1mol·L-1,则K=160;
第二种情况:设c(NO)=amol·L-1,则K=160/a;
第三种情况:设c(NO)=amol,则K=160V/a
【解析】
试题分析:I.(1)A.根据物料守恒,c(A2-)+c(HA-)=0.1mol/L,故A错误;
B.根据质子守恒得:c(OH-)=c(H+)+c(HA-),故B正确;
C.0.1mol/L的Na2A溶液中,存在电荷守恒:c( Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),故C正确;
D.原子守恒可以得出c(Na+)=2c(A2-)+2c(HA-),故D正确;故答案为A;
(2)因为0.1molL-1NaHA溶液的pH=2,则由HA-H++A2-可知,电离出0.01mol/LH+;而0.1molL-1H2A溶液,H2A=H++HA-,电离出H+0.1mol/L和HA-0.1mol/L,但第一步电离生成的H+抑制了HA-的电离,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L;
Ⅱ.①0.1000molL-1的H3PO3溶液pH的读数为1.6,氢离子浓度小于亚磷酸浓度,所以亚磷酸是二元弱酸,在水中分步电离,且第一步电离程度大于第二步,两步电离中都有氢离子生成,所以氢离子浓度最大,离子浓度大小顺序是c(H+)> c(H2PO3-)> c(HPO32-);
②亚磷酸是二元酸,亚磷酸和少量氢氧化钠反应生成NaH2PO3、H2O,所以该反应方程式为:H3PO3+OH-=H2PO3-+H2O;
Ⅲ.(1)已知:H2(g)的燃烧热为285.8kJmol-1,则其热化学方程式为:H2(g) + 1/2O2(g) = H2O(l) △H=-285.8 kJ/mol①;CH2=CH2(g)的燃烧热为1411.0 kJmol-1,其热化学方程式为:C2H4(g) + 3O2(g) = 2H2O(l) + 2CO2(g) △H=-1411.0 kJ/mol ②;H2O(g)=H2O(l) △H=-44.0 kJmol-1③;利用盖斯定律将①×6-②-③×4可得:6H2(g)+2CO2(g)CH2═CH2(g)+4H2O(g) △H=-127.8kJmol-1;
(2)①化学反应速率随温度的升高而加快,催化剂的催化效率降低,所以v(M)有可能小于v(N),故①不正确;②升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故②正确;③温度低于250℃时,随温度升高平衡逆向进行乙烯的产率减小,故③不正确;④温度越高反应速率越快,N点温度比M点高,则N点正反应速率一定大于M点正反应速率,故④正确;⑤为提高CO2的转化率,平衡正向进行,反应是放热反应,低的温度下进行反应,平衡正向进行,但催化剂的活性、反应速率减小,故⑤不正确;故答案为①③⑤ ;
Ⅳ.若在500℃时,投料![]() =1,NO的转化率为80%,
=1,NO的转化率为80%,
设c(NO)=1molL-1,
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g).
2CO2(g)+N2(g).
起始量(mol/L) 1 1 0 0
变化量(mol/L) 0.8 0.8 0.8 0.4
平衡量(mol/L) 0.2 0.2 0.8 0.4
则此温度时的平衡常数K=![]() =160;
=160;
设c(NO)=amolL-1,
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始量(mol/L) a a 0 0
变化量(mol/L) 0.8a 0.8a 0.8a 0.4a
平衡量(mol/L) 0.2a 0.2a 0.8 a 0.4a
则K=![]() =160/a;
=160/a;
设n(NO)=amol,容器的容积为V L,
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始量(mol/L) a/V a/V 0 0
变化量(mol/L) 0.8a/V 0.8a/V 0.8a/V 0.4a/V
平衡量(mol/L) 0.2a/V 0.2a/V 0.8a/V 0.4a/V
则K=![]() =160V/a。
=160V/a。

 阅读快车系列答案
阅读快车系列答案【题目】下图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,符合这一情况的是( )
a极板 | b极板 | a电极 | Z溶液 | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 正极 | CuCl2 |

A. A B. B C. C D. D