题目内容
3.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有SiO2、Al2O3、Fe2O3等杂质.以铬铁矿为原料制备重铬酸钾(K2Cr2O7)、重铬酸钠(Na2Cr2O7)的过程如下图所示.

已知:①NaFeO2遇水强烈水解:NaFeO2+2H2O=NaOH+Fe(OH)3↓;
②Cr2O72-+H2O═2CrO42-+2H+. 请回答:
(1)“焙烧”后的固体产物成分除Na2CrO4、NaFeO2外,还有NaAlO2、Na2SiO3(填化学式)
等.写出“焙烧”过程中所发生的氧化还原反应的化学方程式4FeO•Cr2O3+7O2+10Na2CO3$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+4NaFeO2+10CO2.
(2)“焙烧”过程中,所产生X气体的电子式为
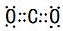 .
.(3)“水浸”步骤中,为了提高浸出率,可采取的措施有(请写出两条):加热;搅拌、研磨或延长浸出时间等.
(4)滤渣1的主要成分是Fe(OH)3.若要进一步分离滤渣2 中的可酸溶成分,请写出酸溶时发生反应的离子方程式Al(OH)3+3H+=Al3++H2O.
(5)含Na2Cr2O7的“混合溶液”经过蒸发并冷却至30~40℃得到的Na2Cr2O7晶体还要进行重结晶,其目的是进一步减少晶体中杂质Na2SO4(填化学式)的含量.
(6)操作Ⅲ由多步组成,向含Na2Cr2O7的母液中加入KCl固体,最终获得K2Cr2O7晶体的操作依次是蒸发浓缩、冷却结晶、过滤、75%乙醇水溶液洗涤、干燥.
分析 铬铁矿的主要成分可表示为FeO•Cr2O3,还含有SiO2、Al2O3、Fe2O3等杂质,将铬铁矿和碳酸钠、氧气混合焙烧,发生反应4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2、Na2CO3+Al2O3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑、Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑、Na2CO3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2NaFeO2+CO2↑,根据方程式知,生成的气体X是二氧化碳;
然后水浸、过滤得到滤渣1和滤液1,根据信息①知,液1中溶质是Na2CrO4、NaAlO2、NaOH,滤渣1为Fe(OH)3;将滤液1通入X气体,溶液中偏铝酸钠和NaOH与二氧化碳溶液生成碳酸钠和氢氧化铝,然后过滤得到滤液2和滤渣2,滤渣2是Al(OH)3,滤液中含有Na2CrO4、Na2CO3和Na2SO4,调节溶液的pH<5,根据信息②知,溶质变为Na2Cr2O7,将混合溶液蒸发浓缩、冷却结晶得到Na2Cr2O7晶体,将晶体溶于母液,然后加入KCl固体,因为Na2Cr2O7的溶解度大于K2Cr2O7,所以得到K2Cr2O7晶体,采用过滤方法得到K2Cr2O7晶体,
(1)根据发生的反应确定固体产物成分;FeO•Cr2O3和氧气发生氧化还原反应;
(2)通过以上分析知,X是二氧化碳,二氧化碳是共价化合物,每个O原子和C原子形成2对共用电子对;
(3)增大反应速率的方法有:升高温度、增大反应物接触面积等;
(4)结合题给信息确定滤渣成分;氢氧化铝易溶于强酸、强碱溶液;
(5)得到的溶液中溶质还有硫酸钠;
(6)从溶液中获取溶质,需要蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
解答 解:铬铁矿的主要成分可表示为FeO•Cr2O3,还含有SiO2、Al2O3、Fe2O3等杂质,将铬铁矿和碳酸钠、氧气混合焙烧,发生反应4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2、Na2CO3+Al2O3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑、Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑、Na2CO3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2NaFeO2+CO2↑,根据方程式知,生成的气体X是二氧化碳;
然后水浸、过滤得到滤渣1和滤液1,根据信息①知,液1中溶质是Na2CrO4、NaAlO2、NaOH,滤渣1为Fe(OH)3;将滤液1通入X气体,溶液中偏铝酸钠和NaOH与二氧化碳溶液生成碳酸钠和氢氧化铝,然后过滤得到滤液2和滤渣2,滤渣2是Al(OH)3,滤液中含有Na2CrO4、Na2CO3和Na2SO4,调节溶液的pH<5,根据信息②知,溶质变为Na2Cr2O7,将混合溶液蒸发浓缩、冷却结晶得到Na2Cr2O7晶体,将晶体溶于母液,然后加入KCl固体,因为Na2Cr2O7的溶解度大于K2Cr2O7,所以得到K2Cr2O7晶体,采用过滤方法得到K2Cr2O7晶体,
(1)通过以上分析知,“焙烧”后的固体产物成分除Na2CrO4、NaFeO2外,还有NaAlO2、Na2SiO3;焙烧过程中发生的氧化还原反应为4FeO•Cr2O3+7O2+10Na2CO3$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+4NaFeO2+10CO2,
故答案为:NaAlO2、Na2SiO3;4FeO•Cr2O3+7O2+10Na2CO3$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+4NaFeO2+10CO2;
(2)通过以上分析知,生成的气体是二氧化碳,其电子式为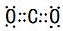 ,故答案为:
,故答案为: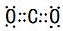 ;
;
(3)“水浸”步骤中,为了提高浸出率,可采取的措施有加热、搅拌、研磨或延长浸出时间等,
故答案为:加热、搅拌、研磨或延长浸出时间等;
(4)通过以上分析知,滤渣1的主要成分是Fe(OH)3;滤渣2中可酸溶成分是氢氧化铝,氢氧化铝和酸反应生成铝离子和水,离子方程式为Al(OH)3+3H+=Al3++H2O,
故答案为:Fe(OH)3 ;Al(OH)3+3H+=Al3++H2O;
(5)含Na2Cr2O7的“混合溶液”经过蒸发并冷却至30~40℃得到的Na2Cr2O7晶体还要进行重结晶,其目的是进一步减少晶体中杂质Na2SO4的含量,
故答案为:Na2SO4;
(6)从溶液中获取晶体的方法是蒸发浓缩、冷却结晶,故答案为:蒸发浓缩;冷却结晶.
点评 本题考查物质的分离和提纯,为高频考点,侧重考查学生分析、自学及信息利用能力,明确流程图中每一步发生的反应及操作方法是解本题关键,结合题给信息解答,题目难度中等.

| A. | 熔融状态下能导电的物质是电解质 | |
| B. | BaSO4虽然难溶,但是强电解质 | |
| C. | NH3的水溶液能导电,所以NH3是电解质 | |
| D. | 弱电解质溶液的导电性比强电解质溶液弱 |
| A. | 硫原子的原子结构示意图: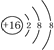 | |
| B. | 过氧化钠的电子式: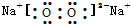 | |
| C. | 原子核内有8个质子、10个中子的氧原子:810O | |
| D. | HClO的结构式为 H-Cl-O |
①根据其溶液是否导电,将物质分为电解质和非电解质
②依据反应中有无电子转移,将化学反应分为氧化还原反应和非氧化还原反应
③根据反应是否有离子参加将反应分为离子反应和非离子反应
④根据组成元素的种类,将纯净物分为单质和化合物
⑤根据分散系是否具有丁达尔效应,将分散系分为溶液、浊液和胶体.
| A. | ①②③④ | B. | ②③④⑤ | C. | ②③④ | D. | ②③⑤ |
| 选项 | 项目 | 结论 |
| A | 三种有机化合物:丙烯、氯乙烯、苯 | 分子内所有原子均在同一平面 |
| B | 由溴丙烷水解制丙醇、由丙烯与水反应制丙醇 | 属于同一反应类型 |
| C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
| D | C4H9Cl的同分异构体数目(不考虑立体异构) | 共有4种 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在 | |
| B. | 用酸性KMnO4溶液检验溴乙烷与NaOH醇溶液共热后的产物是否是乙稀 | |
| C. | 用溴水鉴别乙烯与乙炔 | |
| D. | CH4和Cl2在光照条件下反应的产物最多可能有四种 |
| A. | 单位时间内生成n molA2同时生成n molAB | |
| B. | 单位时间内生成2n molAB的同时生成n molB2 | |
| C. | 容器内气体总压强不再随时间的变化而变化 | |
| D. | 容器内混合气体的平均摩尔质量不再随时间的变化而变化 |