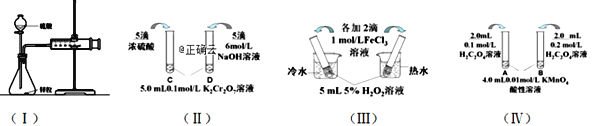
��Ŀ����
����Ŀ����1����֪CH3OH(l)��ȼ������H����238.6kJ/mol��CH3OH(l)��3/2O2(g)=CO2(g)��2H2O(g) ��H����a kJ/mol����a________238.6(����>������<����������)��
��2����ӦmA(g)+nB(g)![]() pC(g)+qD(g)�����е������仯��ͼ��ʾ���ش��������⡣
pC(g)+qD(g)�����е������仯��ͼ��ʾ���ش��������⡣
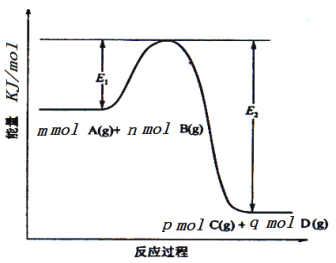
�÷�Ӧ��H=_____________________(�ú�E1��E2ʽ�ӱ�ʾ)���ڷ�Ӧ��ϵ�м��������E1___________��E2___________(������С������)��
��3����֪����ʱ���ױȰ����ȶ�����֪��
��P4�����ף�s��+5O2(g)=2P2O5(s) ��H1
��4P�����ף�s��+5O2(g)=2P2O5(s) ��H2
�ȽϷ�Ӧ����H�Ĵ�С����H1_______��H2����������������������=������
��4����֪��ϡ��Һ�У�H+(aq)+OH(aq)=H2O(l) ��H=��57.3 kJ![]() ����Ũ������ϡ����������Һ��Ӧ����1molˮ���ų�������________57.3 kJ����������������������=������
����Ũ������ϡ����������Һ��Ӧ����1molˮ���ų�������________57.3 kJ����������������������=������
���𰸡��� -��E2-E1��kJ/mol ��С ��С �� ��
��������
��1��1mol CH3OH(l)��ȫȼ������Һ̬ˮ�ų�������Ϊ238.6 kJ��CH3OH(l)��3/2O2(g)=CO2(g)��2H2O(g) ��H����a kJ/mol�У����ɵ�Ϊ��̬ˮ������̬ˮ��ΪҺ̬ˮ���ȣ���a<238.6��
����<��
��2������ͼʾ����Ӧ������������������������������ӦΪ���ȷ�Ӧ��E1Ϊ��Ӧ��Ļ�ܣ�E2Ϊ������Ļ�ܣ��÷�Ӧ�ķ�Ӧ����H= -��E2- E1��kJ/mol�������ɽ��ͷ�Ӧ�Ļ�ܣ����淴Ӧ�Ļ�ܶ����ͣ�E1��С��E2��С��
��Ϊ����С����С��
��3����֪����P4(���ף�s)+5O2(g)=2P2O5(s) ��H1
��4P(���ף�s)+5O2(g)=2P2O5(s) ��H2
���ٵõ���Ӧ��4P(����,s)=P4(����,s)����H=��H2��H1��
���ױȰ����ȶ�,˵�������������ڰ���,���Է�Ӧ4P(����,s)=P4(����,s)�����ȷ�Ӧ������H=��H2��H1>0������ʱ���ױȰ����ȶ���˵�����������ߣ���Ӧ�ų��������϶࣬����H<0����ų�������Խ�෴Ӧ��ԽС����H1<��H2;
�ʴ�Ϊ��<;
��4��Ũ������ϡ����������Һ��Ӧ����1molˮʱ��������кͷ�Ӧ�����⣬Ũ��������ˮʱҲ�ų��ȣ����·�Ӧ�ų�������>57.3 kJ;
����>��

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�����Ŀ�������ڵĵ�������Ҫ�ĸ��¼������ϡ�һ���Ժ����ؽ�����������������Se��Te��Ag��Pb��Cu�ȵ��ʣ�Ϊԭ���Ʊ������ڵĹ���������ͼ��ʾ��
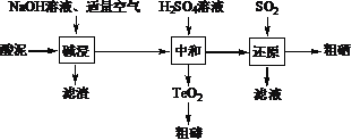
��֪����H2SeO3������ˮ��TeO2������ˮ��
�����к��������в�ò�ͬpH������������±���
���к����յ�pH | ��Һ/��g��L-1�� | ������/�� | ||
Se | Te | Se | Te | |
4 | 11.2 | 0.029 | 8.9 | 98.1 |
5 | 13.7 | 0.01 | 5.8 | 98.9 |
6 | 12.4 | 0.013 | 4.1 | 91.6 |
�ش��������⣺
��1����֪�������������������Na2SeO3��Na2TeO3�������������к���Cu��__��д��Se�μӷ�Ӧ�����ӷ���ʽ____��
��2���������������ͨ�����Ӧ������ԭ����___��
��3�����к�������������TeO2�Ļ�ѧ����ʽ��____��
��4�����к����յ�pHӦѡ����____������ԭ����___��
��5������Һ���ɷ���____����ѭ��ʹ�á�
��6��Ҫ��ȡ395g��������������Ϊ80����������������Ӧͨ���״���µ�SO2____L��