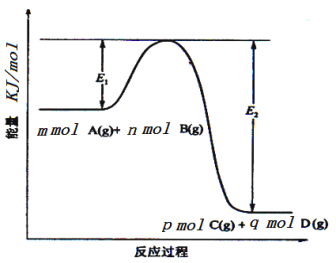
题目内容
【题目】某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水,当K闭合时,SO42—从右向左通过交换膜移向A极。下列分析正确的是
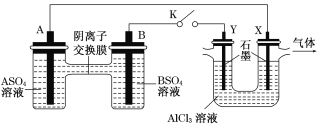
A. 溶液中c(A2+)减小
B. B极的电极反应:B-2e-=B2+
C. Y电极上有H2产生,发生还原反应
D. 反应初期,X电极周围出现白色胶状沉淀
【答案】D
【解析】
A.据右面图示可知,左侧装置为原电池,右侧为电解池。由题意在交换膜处SO42-从右向左移动可知,A为原电池的负极,电极反应式为:A-2e-=A2+, A2+的浓度增大,故A分析错误;
B.B电极为原电池的正极,电极反应式为:B2++2e-=B,故B分析错误;
C.Y电极与原电池的正极B相连,即y电极为电解池的阳极,发生氧化反应,电极反应式为:2Cl一 一2e一=C12↑。故C分析错误;
D.X电极为电解池的阴极,其电极反应式为2H+ + 2e-+ =H2 ↑,由于H+来自于H2O,从而破坏水的电离平衡,使溶液显碱性,所以会发生此反应:AI3++3OH-=Al(OH)3,故D分析正确;
答案选D。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
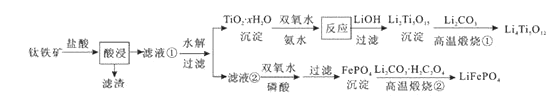
下列说法不正确的是( )
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O↑+3CO2↑
2LiFePO4+H2O↑+3CO2↑
D.TiO2 · xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/ ℃ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
可知,40 oC前,未达到平衡状态,随着温度升高,转化率变大;40 oC后,H2O2分解加剧,转化率降低
【题目】汽车尾气中含有CO、NO、NO2、碳氢化合物等多种污染物。回答下列问题:
(1)已知:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
①若H2O(1)=H2O(g) △H=+44kJ·mol-1,则表示辛烷燃烧热的热化学方程式为______________________________________________。
②部分化学键键能数据如下:
化学键 | O=O | C=O | C≡O |
E/(kJ·mol) | 494 | 799 | 1076 |
△H2=__________kJ·mol-1
(2)1573K时,N2+O2![]() 2NO平衡常数为2. 0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0. 2mol、0. 001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
2NO平衡常数为2. 0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0. 2mol、0. 001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
(3)反应NO(g)+CO(g)=N2(g)+CO2(g)的平衡常数为1. 68×1060,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是________________,要增大汽车尾气净化装置中单位时间内该反应的程度,关键是要_____________。
(4)T<500K时,反应NO2(g)+CO(g)=NO(g)+CO2(g)分两步进行:
第一步:NO2(g)+NO2(g)→NO3(g)+NO(g) (慢反应)
第二步:NO3(g)+CO(g)→NO(g)+CO2(g) (快反应)
下列表述正确的是__________(填标号)
A. 反应速率与NO浓度有关 B. 反应速率与NO2浓度有关
C. 反应的中间产物只有NO3 D. 第二步反应活化能较高
【题目】根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向盛有KI3溶液的试管中加入适量CCl4,振荡后静置,CCl4层显紫色(已知I3- | KI3在CCl4中的溶解度比在水中的大 |
B | 向淀粉溶液中加入稀硫酸水浴加热后,再加入银氨溶液水浴加热,未出现银镜 | 淀粉未发生水解 |
C | 向饱和Na2CO3溶液中加入少量BaSO4粉末搅拌,过滤,向洗净的沉淀中加入稀盐酸,有气体放出 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 向新制饱和氯水中滴加紫色石蕊试液,溶液先变红后褪色 | 氯水具有酸性和漂白性 |
A.AB.BC.CD.D