题目内容
7. 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )| A. | 反应的化学方程式是X+2Y?2Z | |
| B. | 该反应在0-3min时间内产物Z的平均反应速率 0.083mol•L-1•min-1 | |
| C. | 该反应达到平衡时反应物X的转化率α等于45% | |
| D. | 其他条件不变,升高温度,若正反应速率增大,则逆反应速率将减小 |
分析 A、依据图象计算达到平衡状态各物质的物质的量变化,物质的量变化之比等于化学方程式计量数之比,据此写出化学方程式;
B、反应速率V=$\frac{△c}{△t}$计算得到;
C、图象得到X的起始量和变化量,依据转化率=$\frac{消耗量}{起始量}$×100%计算得到;
D、升高温度增大反应速率,正逆反应速率都增大.
解答 解:A、依据图象计算达到平衡状态各物质的物质的量变化,物质的量变化之比等于化学方程式计量数之比,物质的量变化分析XY为反应物,Z为生成物,物质的量变化之比为,n(X):n(Y):n(Z)=(1.0mol-0.55mol):(1.0mol-0.1mol):0.9mol=1:2:2,据此写出化学方程式为X+2Y?2Z,故A正确;
B、反应速率V=$\frac{△c}{△t}$,该反应在0-3min时间内产物Z的平均反应速率=$\frac{\frac{0.5mol}{2L}}{3min}$=0.083mol•L-1•min-1,故B正确;
C、图象得到X的起始量为1.0mol,平衡量为0.55mol,变化量为1mol-0.55mol=0.45mol,依据转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.45mol}{1mol}$×1005=45%,故C正确;
D、升高温度增大反应速率,正逆反应速率都增大,只是增大程度不同,故D错误;
故选D.
点评 本题考查了化学图象的分析判断,化学反应速率、转化率概念的计算分析,主要是化学方程式书写方法和影响反应速率因素的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
17.2010年11月12日至27日广州成功举办了第16届亚运会.广州采取了一系列节能减排、改善环境质量的措施.下列说法错误的是( )
| A. | 发展核能发电,以减少火力发电带来的SO2和CO2的排放问题 | |
| B. | 发展低碳经济,利用太阳能、风能实现城市照明 | |
| C. | 推行“限塑令”,研发用二氧化碳合成聚碳酸酯类可降解塑料 | |
| D. | 使用填埋法或焚烧法处理未经分类的生活垃圾 |
15.下列事实不能用电化学原理解释的是( )
| A. | 铁片在潮湿的环境中生锈 | |
| B. | 远洋海轮的尾部装上一定数量的锌板 | |
| C. | 银制器皿露置在空气中发黑 | |
| D. | 用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 |
2.下列4个有机化合物中,能够发生酯化、加成和氧化3种反应的是( )
①CH2=CHCOOH ②CH2=CHCOOCH3 ③CH2=CHCH2OH ④CH3CH2CH2OH⑤
①CH2=CHCOOH ②CH2=CHCOOCH3 ③CH2=CHCH2OH ④CH3CH2CH2OH⑤

| A. | ①③④ | B. | ②④ | C. | ①③⑤ | D. | ①②③⑤ |
19.已知,aK(n-1)+、bLn+、cWn-、dD(n+1)-具有相同的电子层结构,关于K、L、W、D四种元素的叙述正确的是( )
| A. | 气态氢化物的稳定性:D>W | |
| B. | 四种元素一定属于短周期元素 | |
| C. | 最高价氧化物对应水化物的碱性:L>K | |
| D. | 原子序数:L>K>W>D |
16.在元素周期表中,第一、二、三周期中所含元素种数分别为( )
| A. | 2、8、8 | B. | 8、8、18 | C. | 2、8、18 | D. | 8、18、18 |
17.已知化合物A的结构简式为 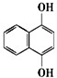 A苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是( )
A苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是( )
 A苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是( )
A苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是( )| A. | 2n=m | B. | n=m | C. | n+m=6 | D. | n+m=8 |


 .
. .
.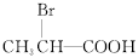 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$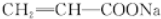 +NaBr+2H2O
+NaBr+2H2O .
. 
 <
<  (填“>”“<”或“=”,下同)
(填“>”“<”或“=”,下同) <
<
 >CH3COOH(提示:类比酚与醇的酸性)
>CH3COOH(提示:类比酚与醇的酸性) ;
; +nHCHO
+nHCHO 
 +nH2O.
+nH2O.