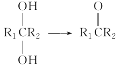��Ŀ����
����Ŀ����ϩ�Ǻϳ�ʳƷ���װ���Ͼ���ϩ�ĵ��壬�����ɶ����ѽ��Ʊ����ѽ�ĸ���ӦΪC4H10(g��������)![]() CH4(g)��C3H6(g)����ش��������⣺
CH4(g)��C3H6(g)����ش��������⣺
(1)��ѧ�ϣ����ȶ����ʵ�������Ϊ0����Ԫ�صĵ��ʻ��ϳɵ�һ������ʱ�ķ�Ӧ�Ƚиû�����������ȣ������ȿɱ�ʾ���������������25 �桢101 kPa�����л�������������±���ʾ��
���� | ���� | ���� | ��ϩ | ��ϩ | ������ | �춡�� |
������/kJ�� mol��1 | ��75 | ��85 | 52 | 20 | ��125 | ��132 |
���������ѽ�������ϩ���Ȼ�ѧ����ʽΪ_____________________________��
(2)һ���¶��£��ں����ܱ�������Ͷ��һ���������鷢����Ӧ������ϩ��
���������˵���÷�Ӧ�ﵽƽ��״̬����________(����)��
A�������ܶȱ��ֲ��� B��c(C2H4)��c(C2H6)/c(C4H10)���ֲ���
C����Ӧ�ȱ��ֲ��� D��������ֽ����ʺ����������������
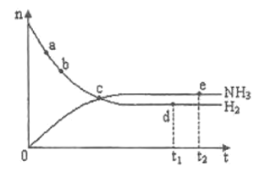
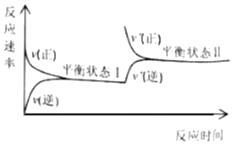
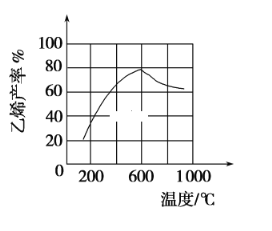
(3)���ܱ������г��������飬��һ������(Ũ�ȡ�������ѹǿ��)�·�����Ӧ�������ϩ�������¶ȹ�ϵ��ͼ��ʾ���¶ȸ���600��ʱ�������¶����ߣ���ϩ���ʽ��ͣ����ܵ�ԭ����____________��
(4)��һ���¶�����10 L�����ܱ������г���2 mol�����飬��Ӧ������ϩ�����飬����10 min�ﵽƽ��״̬�����ƽ��ʱ����ѹǿ��ԭ����1.75����
��0��10 min���������������v(C2H6)��________ mol��L��1��min��1��
�����������£��������ƽ��ת����Ϊ_______���÷�Ӧ��ƽ�ⳣ��KΪ_____��
(5)��������ȼ�ϵ�������ڵ�K2CO3(���в���O2����HCO3-)Ϊ����ʣ��Ծ��д����ú͵������ܵ�ϡ����������Ϊ�缫����ȼ�ϵ�ص�������ӦʽΪ26CO2��13O2��52e��===26CO32-������ӦʽΪ_________________________��
���𰸡�C4H10(g��������)![]() C2H4(g)��C2H6(g) ��H ����92kJ�� mol�� BD �������Խ��ͣ����������� 0.015 75% 0.45 C4H10��13CO32-��26e��===17CO2��5H2O
C2H4(g)��C2H6(g) ��H ����92kJ�� mol�� BD �������Խ��ͣ����������� 0.015 75% 0.45 C4H10��13CO32-��26e��===17CO2��5H2O
��������
��1����Ӧ����ʽ���ʱ�=�������������-��Ӧ��������ȣ�
��2�����淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ����Լ��ɴ������һϵ�����������䣻
��3�������������¶�Ӱ�죬�л���ѧ��Ӧ�и���Ӧ�϶ࣻ
��4�����º��������£������ѹǿ֮�ȵ��������ʵ���֮�ȣ�����10min�ﵽƽ��״̬�����ƽ��ʱ����ѹǿ��ԭ����1.75����˵��ƽ������������ʵ�����ԭ����1.75��������������ʵ���=2mol��1.75=3.5mol��
���ӵ����ʵ����൱�����ɵ�n��C2H4��=n��C2H6��=��3.5-2��mol=1.5mol��ʣ���n��C4H10��=��2-1.5��mol=0.5mol��ƽ��ʱc��C2H4��=c��C2H6��=![]() =0.15mol/L��c��C4H10��=
=0.15mol/L��c��C4H10��=![]() =0.05mol/L��
=0.05mol/L��
��0��10min���������������v��C2H6��=![]() ��
��
�����������£��������ƽ��ת����=![]() ��100%���÷�Ӧ��ƽ�ⳣ��K=
��100%���÷�Ӧ��ƽ�ⳣ��K=![]() ��
��
��5�������϶���ʧ���Ӻ�̼������ӷ�Ӧ���ɶ�����̼��ˮ��
��1����Ӧ����ʽ���ʱ�=�������������-��Ӧ��������ȣ����Ը÷�Ӧ���ʱ�=��52-85+125��kJ/mol=+92kJ/mol���������Ȼ�ѧ����ʽΪC4H10��g�������飩C2H4��g��+C2H6��g����H=+92kJmol-1��
��2��A����Ӧǰ���������������䡢����������䣬�����ܶ�ʼ�ղ��䣬���ܸ����ܶ��ж�ƽ��״̬����A����B��c��C2H4��c��C2H6��/c��C4H10�����ֲ���ʱ�������ʵ����ʵ���Ũ�Ȳ��䣬˵���ﵽƽ��״̬����B��ȷ��C����Ӧ��������������ȣ����Ƿ�ﵽƽ��״̬�أ���C����D��������ֽ���������������������ȣ����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����D��ȷ���ʴ�ΪBD��
��3�������������¶�Ӱ�죬�л���ѧ��Ӧ�и���Ӧ�϶࣬�����¶����ߣ���ϩ���ʽ��ͣ����ܵ�ԭ���Ǵ������Խ��ͣ����������ࣻ
��4�����º��������£������ѹǿ֮�ȵ��������ʵ���֮�ȣ�����10min�ﵽƽ��״̬�����ƽ��ʱ����ѹǿ��ԭ����1.75����˵��ƽ������������ʵ�����ԭ����1.75��������������ʵ���=2mol��1.75=3.5mol��
���ӵ����ʵ����൱�����ɵ�n��C2H6��=n��C2H4��=��3.5-2��mol=1.5mol��ʣ���n��C4H10��=��2-1.5��mol=0.5mol��ƽ��ʱc��C2H6��=c��C2H4��=![]() =0.15mol/L��c��C4H10��=
=0.15mol/L��c��C4H10��=![]() =0.05mol/L��
=0.05mol/L��
��0��10min���������������v��C2H6��=![]() =
=![]() mol/��Lmin��=0.015mol/��Lmin����
mol/��Lmin��=0.015mol/��Lmin����
�����������£��������ƽ��ת����=![]() ��100%=
��100%=![]() ��100%=75%���÷�Ӧ��ƽ�ⳣ��K=
��100%=75%���÷�Ӧ��ƽ�ⳣ��K=![]() =
=![]() =0.45��
=0.45��
��5�������϶���ʧ���Ӻ�̼������ӷ�Ӧ���ɶ�����̼��ˮ���缫��ӦʽΪC4H10+13CO32--26e--=17CO2+5H2O��