题目内容
【题目】已知:AG=lgc(H+)/c(OH-),室温下用0.01mol·L1 NH3·H2O溶液滴定20.00mL 0.01mol·L1某一元酸HA,可得下图所示的结果,下列说法中错误的是
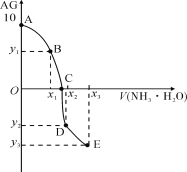
A. 该滴定实验最好选用甲基橙作指示剂
B. 整个过程中,C点时水的电离程度最大
C. 若x3=30,则有:3c(OH)=c(NH4+)+3c(H+)-2c(NH3·H2O)
D. A→C的过程中,可存在:c(A)>c(H+)>c(NH)>c(OH)
【答案】B
【解析】
A、由A点可知0.01mol·L1HA溶液中c(H+)=0.01mol·L1,所以HA为强酸,因为氨水是弱碱,所以滴定时应该选用甲基橙作指示剂,故A说法正确;
B、整个滴定过程中,当酸碱恰好反应生成盐时,水的电离程度最大,由于生成的盐是强酸弱碱盐,此时溶液显酸性,而C点为中性,故B说法错误;
C、若x3=30,根据电荷守恒有:c(OH)+c(A)=c(NH4+)+c(H+),根据物料守恒有3c(A)=2[c(NH)+c(NH3·H2O)],二者联合解得:3c(OH)=c(NH4+)+3c(H+)-2c(NH3·H2O),故C说法正确;
D、A→C的过程中,若加入的氨水的量很少时,溶液中H+和A较多,此时可存在:c(A)>c(H+)>c(NH4+)>c(OH),故D说法正确。

练习册系列答案
相关题目