题目内容
【题目】常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000 mol·L-1某酸(HA)溶液,溶液中HA、A-的物质的量分数δ(X)随pH的变化如图所示。[已知δ(X)=![]() ]下列说法正确的是
]下列说法正确的是
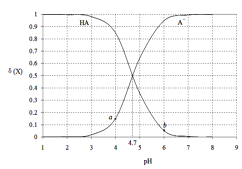
A.Ka(HA)的数量级为10-5
B.溶液中由水电离出的c(H+):a点>b点
C.当pH=4.7时,c(A-)+c(OH-)=c(HA)+c(H+)
D.当pH=7时,消耗NaOH溶液的体积为20.00mL
【答案】A
【解析】
A. 曲线的交点处,c(HA)=c(A-),此时pH=4.7,则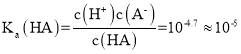 因此Ka(HA)的数量级为10-5,A项正确;
因此Ka(HA)的数量级为10-5,A项正确;
B. a点、b点溶液均显酸性,均抑制水的电离,a点pH较小,溶液酸性较强,抑制水的电离程度更大,因此,溶液中由水电离出的c (H+):a点<b点,B项错误;
C. 当pH=4.7时,c(HA)=c(A-),但c(OH-)不等于 c(H+),C项错误;
D. HA为弱酸,当消耗NaOH溶液的体积为20.00 mL时,二者恰好反应生成NaA溶液,溶液显碱性,pH>7,D项错误;
答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H2分子 | N2分子 | NH3分子 |
键能(kJ·mol-1) | 436 | 945 | 391 |
(1)根据上表中的数据判断工业合成氨的反应是__(填“吸热”或“放热”)反应;
(2)在298K时,取1molN2和3molH2放入一密闭容器中,在催化剂存在下进行反应,理论上生成2molNH3时放出或吸收的热量为Q,则Q为___。