题目内容
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+ B(g)![]() 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法错误的是( )
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法错误的是( )
A.平衡不移动
B.相当长时间后,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,C的体积分数增大
D.相当长时间后,正反应速率增大,逆反应速率也增大
【答案】C
【解析】
A.由于反应前后气体的化学计量数之和相等,则增大压强平衡不发生移动,A正确;
B.由于反应前后气体的化学计量数之和相等,则增大压强化学平衡不移动,再次达到平衡时,A、B和C的物质的量之比仍为2:2:1,B正确;
C.由于反应前后气体的化学计量数之和不变,则增大压强平衡不移动,导致再次达到平衡时,C的体积分数不变,C错误;
D.由于反应物和生成物的浓度都增大,所以再达平衡时,正逆反应速率都增大,D正确;
故合理选项是C。

 阅读快车系列答案
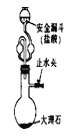
阅读快车系列答案【题目】氯化铜晶体(CuCl22H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Cu2+ Fe2+ Fe3+ | 4.7 7.0 1.9 | 6.7 9.0 3.2 |
(1)操作I加入X的目的是_________________________。
(2)下列物质都可以作为X,最适合本实验的X物质可以是(填选项)_________。
A.KMnO4 B.H2O2 C.NaClO D.Cl2
(3)操作II的Y试剂为(填化学式)_________,并调节溶液的pH在_________范围。
(4)操作III的程序依次为蒸发浓缩、冷却结晶、过滤、自然干燥、得到CuCl22H2O晶体。
(5)实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示):________________。
【题目】乳酸亚铁晶体{CH3CH(OH)COO]2Fe·3H2O}是一种很好的食品铁强化剂,易溶于水,广泛应用于乳制品、营养液等,吸收效果比无机铁好,可由乳酸与FeCO3反应制得:2CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑
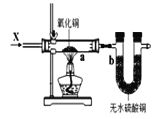
Ⅰ.制备碳酸亚铁(FeCO3):装置如图所示。

(1)仪器C的名称是______。
(2)清洗仪器,检查装置气密性,A中加入 盐酸,B中加入铁粉,C中加入NH4HCO3溶液。为顺利达成实验目的,上述装置中活塞的打开和关闭顺序为:关闭活塞_____,打开活塞_____,装置B中可观察到的现象是_____,当加入足量盐酸后,关闭活塞1,反应一段时间后,关闭活塞_____,打开活塞_____。C中发生的反应的离子方程式为_____。
Ⅱ. 制备乳酸亚铁晶体:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸。
(3)加入少量铁粉的作用是_____。从所得溶液中获得乳酸亚铁晶体所需的实验操作是隔绝空气低温蒸发,冷却结晶、过滤、洗涤、干燥。
Ⅲ.乳酸亚铁晶体纯度的测量:
(4)若用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其原因可能是_____。
(5)经查阅文献后,改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.76g样品,溶解后进行必要处理,用容量瓶配制成250mL溶液,每次取25.00 mL,用0.100mol/LCe(SO4)2标准溶液滴定至终点,记录数据如表所示。
滴定次数 | 0.100mol/LCe(SO4)2标准溶液/mL | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 19.65 |
2 | 0.12 | 22.32 |
3 | 1.05 | 20.70 |
则产品中乳酸亚铁晶体的纯度为______(以质量分数表示,保留3位有效数字)。