题目内容
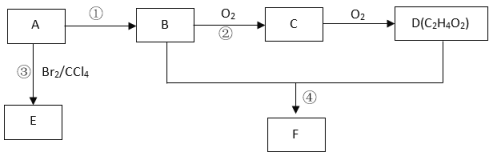
【题目】在下述转化关系中,已知B、D都是淡黄色固体,且A与D为单质,并可反应生成离子化合物。试回答:
(1) G的化学式为________;
(2)写出B的电子式______________。
(3)写出B +水→C的化学反应方程式_______。
(4)B和E反应也可生成H,则该反应的化学方程式为____。
【答案】H2SO4 ![]() 2Na2O2+2H2O=4NaOH+O2↑ Na2O2 +SO2=Na2SO4
2Na2O2+2H2O=4NaOH+O2↑ Na2O2 +SO2=Na2SO4
【解析】
常见淡黄色固体有Na2O2和S,其中B能与水反应生成氧气,则B为Na2O2,A为Na,C为NaOH,D可以与氧气连续反应,则D为S,E为SO2,F为SO3,G为H2SO4,G与NaOH发生中和反应生成H为Na2SO4,然后根据题目要求写出相应物质的化学式、电子式或相应反应的方程式。
根据上述推断可知A是Na,B是Na2O2,C是NaOH,D是S,E是SO2,F是SO3,G是H2SO4,H为Na2SO4。
(1)根据上述推断可知G是硫酸,则G的化学式为H2SO4;
(2) B是Na2O2,Na2O2是离子化合物,两个O原子通过一对共用电子对结合,每个Na原子失去1个电子形成Na+,每个O原子再获得一个电子形成O22-,O22-与2个Na+通过离子键结合,故该物质的电子式为![]() ;
;
(3)过氧化钠与水反应产生氢氧化钠和氧气,反应的方程式为:2Na2O2+2H2O=4NaOH+O2↑;
(4) Na2O2具有强的氧化性,SO2具有还原性,二者发生氧化还原反应产生硫酸钠,根据电子守恒、原子守恒,可得该反应的化学方程式为Na2O2 +SO2=Na2SO4。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】下列各组物质中,不能按![]() (“→”表示一步完成)的关系相互转化的是( )
(“→”表示一步完成)的关系相互转化的是( )
选项 | a | b | c |
A | Fe | FeCl2 | FeCl3 |
B | Si | SiO2 | SiF4 |
C | HNO3 | NO | NO2 |
D | Al | Al2O3 | Al(OH)3 |
A. A B. B C. C D. D
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易反应生成一种无氧酸和两种氮的常见氧化物。亚硝酰氯应用广泛,可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
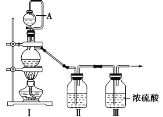
(1)甲组同学拟制备原料气NO和Cl2,制备装置如图所示,为制备纯净干燥的气体,补充右表中缺少的药品。
装置Ⅰ | 装置Ⅱ | ||
蒸馏烧瓶中 | A仪器中 | ||
制备纯净的Cl2 | MnO2 | ①______ | ②______ |
制备纯净的NO | Cu | ③______ | ④______ |
(2)乙组同学对甲组同学制取NO的装置略加改良,结合甲组制得的Cl2共同制备NOCl,装置如图所示:
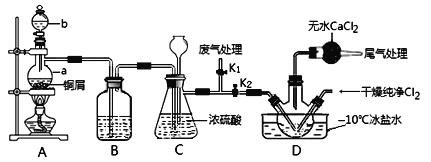
①仪器b的名称为________________。
②组装好实验装置后应先______________,然后依次装入药品。此实验关键操作有两点:一是将Cl2充满D装置的三颈瓶中;二是A中反应开始时要先关闭K2,打开K1,待NO充满装置后再关闭K1,打开K2。这两步操作中充满的目的都是__________________________________________________。
③若C装置中压强过大,可以观察到的现象是_________________________。
④装置D中冰盐水的作用是__________________。
(3)亚硝酰氯(NOCl)纯度的测定:将所得亚硝酰氯(NOCl)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用0.8mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 22.50mL。(已知:Ag2CrO4为砖红色固体)
①亚硝酰氯(NOCl)与水反应的化学方程式为_________________________。
②亚硝酰氯(NOCl)的质量分数为______________________。