题目内容
【题目】同温同压下,相同物质的量的铝、铁分别与足量盐酸反应时,放出氢气的体积比是( )
A.1∶1B.3∶1C.3∶2D.2∶3
【答案】C
【解析】
根据反应方程式以及阿伏加德罗推论进行分析;
铝、铁分别与盐酸反应,属于氧化还原反应,因此采用得失电子数目守恒进行计算,Al与盐酸反应:n(Al)×3=n(H2)×2,Fe与盐酸反应:n(Fe)×2=n(H2)×2,铝和铁的物质的量相等,同温同压下,气体体积之比等于物质的量之比,因此放出氢气的体积比为3:2,故C正确;
故答案为:C。

练习册系列答案
 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
【题目】根据要求回答下列问题:
(1)用大理石和100ml某稀盐酸反应制CO2 ,产生CO2的体积与反应时间的关系如图所示,其中产生CO2速率最快的为____段(选填“OE”、“EF”或“FG”),若该段内生成标准状况下的CO2 448mL,所用时间为2min,该段时间内用HCl来表示其反应速率,则速率为_____,(忽略反应后溶液体积的变化),若要使该反应的反应速率加快,下列措施可行的是______(填字母)。
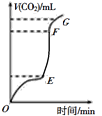
A.将大理石换用碳酸钙粉末 B.加入K2SO4溶液 C.升高温度
D.加入NaCl固体 E.增大盐酸的浓度
(2)对于反应2A2+B2=2A2B,已知A2、B2、A2B的键能如下表:
化学键 | A-A | B=B | A-B |
键能/kJ/mol | 236 | 406 | 163 |
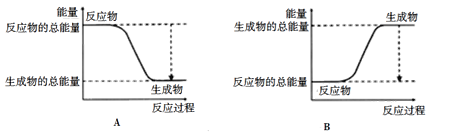
下图能正确表示该反应过程中能量变化的选项是_______(填字母)。