题目内容
【题目】(1)某烃的结构简式是![]() ,分子中饱和碳原子数为 _________,可能在同一平面上的碳原子数最多为 _________
,分子中饱和碳原子数为 _________,可能在同一平面上的碳原子数最多为 _________
(2)从某些植物树叶提取的挥发油中含有下列主要成分:
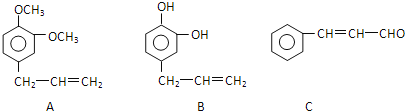
①C的含氧官能团名称为______。
②在这三种物质中,_______显酸性,________能发生银镜反应(填A、B或C)
③这三种物质都不能发生的反应有 __________。
A. 氧化反应 B.取代反应 C.消去反应 D.还原反应
④1 mol A与足量的浓溴水充分反应,消耗溴单质的物质的量为______ 。
⑤C发生加聚反应的产物的结构简式为_______________
【答案】4 8 醛基 B C C 1 mol 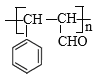
【解析】
(1)根据饱和C原子能结合4个原子的最大数目分析;根据乙烯分子是平面分子,乙炔分子是直线型分子分析共平面的碳原子数目;
(2)①根据C的含氧官能团结构确定其名称;
②酚羟基具有酸性,醛基能够发生银镜反应;
③根据三种物质的结构及官能团的性质分析判断;
④碳碳双键能与溴水发生加成反应,反应的比例是1:1;
⑤每个分子中碳碳双键断裂,这些不饱和碳原子彼此连接形成高分子化合物。
(1)某烃的结构简式是![]() ,在该分子中,2个乙基的4个C原子都是饱和C原子,而形成碳碳双键、碳碳三键的C原子没有达到结合其它原子的最大数目,属于不饱和C原子,因此饱和碳原子数为4;乙烯分子CH2=CH2是平面分子,乙炔分子HC≡CH是直线型分子,-C≡CH可看作是取代乙烯分子中H原子的位置,在该平面上;2个乙基中与碳碳双键连接的亚甲基C原子取代乙烯分子中H原子的位置,在乙烯分子的平面上,以亚甲基C原子为研究对象,由于饱和C原子形成的是四面体结构,最多有2个顶点与该C原子在同一平面上,所以2个-CH3的C原子也可以在乙烯分子的平面内,故可能在同一平面上的碳原子数最多为8个;
,在该分子中,2个乙基的4个C原子都是饱和C原子,而形成碳碳双键、碳碳三键的C原子没有达到结合其它原子的最大数目,属于不饱和C原子,因此饱和碳原子数为4;乙烯分子CH2=CH2是平面分子,乙炔分子HC≡CH是直线型分子,-C≡CH可看作是取代乙烯分子中H原子的位置,在该平面上;2个乙基中与碳碳双键连接的亚甲基C原子取代乙烯分子中H原子的位置,在乙烯分子的平面上,以亚甲基C原子为研究对象,由于饱和C原子形成的是四面体结构,最多有2个顶点与该C原子在同一平面上,所以2个-CH3的C原子也可以在乙烯分子的平面内,故可能在同一平面上的碳原子数最多为8个;
(2)①C结构简式是![]() ,其中的含氧官能团结构是-CHO,其名称是醛基;
,其中的含氧官能团结构是-CHO,其名称是醛基;
②物质 含有酚羟基,能够微弱电离产生H+,因此具有酸性,故合理选项是B;
含有酚羟基,能够微弱电离产生H+,因此具有酸性,故合理选项是B;![]() 含有醛基,能够与银氨溶液在水浴加热条件下发生银镜反应,故合理选项是C;
含有醛基,能够与银氨溶液在水浴加热条件下发生银镜反应,故合理选项是C;
③A.这三种物质都是有机物,能够发生燃烧反应,燃烧反应属于氧化反应,A不符合题意;
B.这三种物质都可以发生苯环上的取代反应,B不符合题意;
C.物质A、C无羟基和卤素原子,不能发生消去反应,B物质含有酚羟基,羟基连接在苯环上,有独特的稳定性,也不能发生消去反应,C符合题意;
D.三种物质都可以与H2发生加成反应,与H2的加成反应属于还原反应,D不符合题意;
故合理选项是C;
④A分子中含有1个碳碳双键,能够与Br2发生加成反应,碳碳双键与Br2发生加成反应时物质的量的比是1:1,所以1 mol A与足量的浓溴水充分反应,消耗溴单质的物质的量为1 mol。
⑤物质C结构简式为![]() ,在一定条件下断裂碳碳双键中较活泼的化学键,然后这些比饱和C原子彼此结合,就形成高分子化合物,则发生加聚反应的产物的结构简式为
,在一定条件下断裂碳碳双键中较活泼的化学键,然后这些比饱和C原子彼此结合,就形成高分子化合物,则发生加聚反应的产物的结构简式为 。
。

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D
【题目】Ⅰ、由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
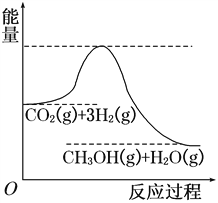
(1)上述反应平衡常数K的表达式为________________,温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是________(填写序号字母)。
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
Ⅱ、(1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,如图所示(T1、T2均大于300℃)
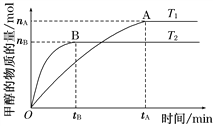
下列说法正确的是________(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________。