题目内容
【题目】在0.2 mol·L-1的CH3COOH溶液中,当CH3COOH![]() H++CH3COO-已达平衡时,若要使CH3COOH的电离程度减小,溶液中的c(H+)增大,应加入( )
H++CH3COO-已达平衡时,若要使CH3COOH的电离程度减小,溶液中的c(H+)增大,应加入( )
A.CH3COONa固体B.氨水C.HClD.H2O
【答案】C
【解析】
A选项,加CH3COONa固体,CH3COO-浓度增加,平衡逆向移动,c(H+)减小,醋酸电离程度减小,故A错误;
B选项,加氨水,消耗氢离子,平衡正向移动,c(H+)减小,醋酸电离程度增大,故B错误;
C选项,加HCl,c(H+)增大,平衡逆向移动,醋酸电离程度减小,故C正确;
D选项,加H2O稀释,平衡正向移动,c(H+)减小,醋酸浓度减小,电离程度增大,故D错误;
综上所述,答案为C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
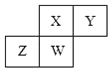
【题目】4种相邻的主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。回答下列问题:
m | n | ||
x | y |
(1)元素x在周期表中的位置是第_____周期、第____族,其单质可采用电解熔融的_____方法制备。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是______,碱性最强的是______.(填化学式)
(3)气体分子(mn)2的电子式为_______,(mn)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是_____________________________。