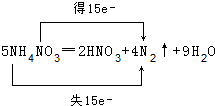
题目内容
10.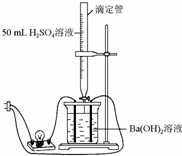 为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,实验设计和实验过程如下:
为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,实验设计和实验过程如下:如图连接好装置,向烧杯中加入25 mL 1 mol•L-1的Ba(OH)2溶液和2滴酚酞溶液,再一边不断地滴加1 mol•L-1的H2SO4溶液,并轻轻振荡.试完成下列内容:
(1)实验现象及分析:①溶液颜色变化为红色变为无色,原因发生酸、碱中和反应,碱的浓度减小.
②灯泡亮度变化:灯泡由亮到暗至灯泡熄灭,然后灯泡又发亮,原因离子浓度越大,导电性越强,生成硫酸钡时离子浓度最小,导电性最差.
③溶液变浑浊,原因生成硫酸钡沉淀.
(2)实验结论:稀H2SO4与Ba(OH)2溶液反应的实质是Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O(可用离子方程式解释).
分析 Ba(OH)2和H2SO4反应的方程式为Ba(OH)2+H2SO4═BaSO4↓+2H2O,利用导电性实验可说明离子反应的发生,以此来解答.
解答 解:(1)由图可知石墨棒、导线、灯泡、烧杯中盛有的Ba(OH)2溶液组成闭合电路,并固定滴定管(盛H2SO4)于铁架台上,再向Ba(OH)2溶液中滴加同浓度的H2SO4溶液直至过量,Ba(OH)2和H2SO4在溶液中的反应为Ba(OH)2+H2SO4═BaSO4↓+2H2O,即实验原理为Ba(OH)2+H2SO4═BaSO4↓+2H2O,
①发生酸、碱中和反应,碱的浓度减小,则观察到溶液由红色变为无色,故答案为:红色变为无色;发生酸、碱中和反应,碱的浓度减小;
②离子浓度越大,导电性越强,生成硫酸钡时离子浓度最小,导电性最差,则灯泡由亮到暗至灯泡熄灭,然后灯泡又发亮,
故答案为:灯泡由亮到暗至灯泡熄灭,然后灯泡又发亮;离子浓度越大,导电性越强,生成硫酸钡时离子浓度最小,导电性最差;
③生成硫酸钡沉淀,则观察到溶液变浑浊,故答案为:生成硫酸钡沉淀;
(2)稀H2SO4与Ba(OH)2溶液反应的实质是Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故答案为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O.
点评 本题考查性质实验方案的设计,为高频考点,把握发生的离子反应及恰好反应生成硫酸钡时导电性最差为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
20.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L水含有NA个H2O分子 | |
| B. | 1mol.L-1 Na2CO3溶液中含有Na+数目为2NA | |
| C. | 常温常压下,22.4LO2中含有2NA个氧原子 | |
| D. | 16g O2 和O3的混合气体中含氧原子数目为NA |
1.下列关于摩尔质量的说法正确的是( )
| A. | HNO3的摩尔质量是63g | |
| B. | 物质的摩尔质量越大,物质的质量越大 | |
| C. | 摩尔质量就等于该物质的相对分子质量 | |
| D. | 醋酸的摩尔质量在数值上与NA个醋酸分子的质量相等 |
18.质量为4.6g的金属钠(含一种杂质)放入足量的盐酸中,可以收集到0.18g的气体,则钠中不可能含有的杂质是( )
| A. | Al | B. | K | C. | Cu | D. | Mg |
6.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法.
Ⅰ.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.
具体流程如下:

有关离子完全沉淀的pH如下表:
(1)写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.亚硫酸氢钠 C.生石灰 D.铁屑
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂为:CD(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
Ⅱ.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:增强溶液导电性.
Ⅰ.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.
具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.亚硫酸氢钠 C.生石灰 D.铁屑
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂为:CD(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
Ⅱ.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:增强溶液导电性.
4.不考虑水的电离,下列水溶液中的四种离子可以大量共存,且物质的量浓度也相等的是( )
| A. | Na+、K+、MnO4-、NO3- | B. | ClO-、I-、NH4+、Ba2+ | ||
| C. | Na+、AlO2-、K+、HCO3- | D. | Al3+、K+、SO42-、NO3- |