题目内容
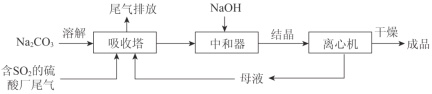
【题目】Na2SO3应用广泛。利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
(1)举例说明向大气中排放SO2导致的环境问题:_________。
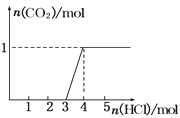
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是_________。
(3)中和器中发生的主要反应的化学方程式是_________。
资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。 |
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因_________。
②结晶时应选择的最佳操作是_________(选填字母)。
A.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是_________、_________。
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
①滴定终点前反应的离子方程式是:![]() IO3-+
IO3-+![]() SO32- =
SO32- =![]() _______ +
_______ +![]() _______(将方程式补充完整)。
_______(将方程式补充完整)。
②成品中Na2SO3(M = 126 g/mol)的质量分数是_________。
【答案】(1)酸雨(2)2CO32- + SO2 + H2O = 2HCO3- + SO32-
(3)NaHSO3 + NaOH = Na2SO3 + H2O
(4)①Na2SO3存在溶解平衡:Na2SO3(s)![]() 2Na+ (aq) + SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动;②b;
2Na+ (aq) + SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动;②b;
(5)BaCl2溶液稀盐酸(6)①![]() IO3- +
IO3- + ![]() SO32- =
SO32- = ![]()
![]() +
+ ![]()
![]() ;②3xy×100%
;②3xy×100%
【解析】
试题分析:(1)向大气中排放SO2会导致酸雨发生;
(2)由图可知,初期反应(图中A点以前)碳酸钠与二氧化硫反应生成碳酸氢钠与亚硫酸钠,反应离子方程式为:2CO32-+SO2+H2O=2HCO3-+SO32-;
(3)随着二氧化硫通入量增大,后期生成主要是得到亚硫酸氢钠,中和器中主要是将亚硫酸氢钠转化为硫酸钠,同时碳酸氢钠反应得到碳酸钠,主要反应化学方程式为:NaHSO3+NaOH=Na2SO3+H2O;
(4)①Na2SO3存在溶解平衡:Na2SO3(s)![]() 2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动,抑制Na2SO3溶解;
2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动,抑制Na2SO3溶解;
②a.加热蒸发直至蒸干,容易使固体溅出,导致损失等,a错误;b.维持95~100℃蒸发浓缩至有大量晶体析出,再利用余热蒸干,b正确;c.由于冷却至33℃以下时析出Na2SO37H2O,应在较高温度下蒸发浓缩结晶,c错误,答案选:b;
(5)用盐酸除去亚硫酸钠,防止干扰,再用氯化钡溶液检验硫酸根离子;
(6)①IO3-与SO32-发生氧化还原反应得到SO42-与I-,I元素化合价降低6价,S元素化合价升高2价,化合价升降最小公倍数为6,可得IO3-的系数为1、SO32-的系数为3,配平后离子方程式为:IO3-+3SO32-=3SO42-+I-;
②消耗KIO3的物质的量为y×10-3L×x mol/L=xy×10-3mol,由IO3-+3SO32-=3SO42-+I-,可知n(Na2SO3)=3n(KIO3)=3xy×10-3mol,则成品中Na2SO3的质量分数为![]() ×100%=3xy×100%。
×100%=3xy×100%。