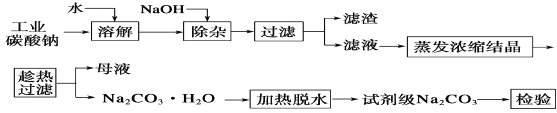
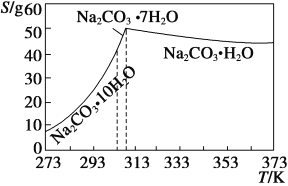
题目内容
【题目】下列有关燃料的说法错误的是( )
A.含硫化石燃料的大量燃烧是形成酸雨的主要原因
B.绿色化学的核心就是利用化学原理对工业生产上造成的环境污染进行彻底治理
C.以压缩天然气、液化石油气代替燃油可减少大气污染
D.燃料不完全燃烧排放的CO是大气污染物之一
【答案】B
【解析】
试题分析:A、生成SO2,SO2是造成酸雨的主要原因,故说法正确;B、绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染,故说法错误;C、天然气和液化石油气能代替燃油减少大气污染,故说法正确;D、空气中不含CO,且CO有毒,是大气污染物之一,故说法正确。

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目