题目内容
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO | SO | NO | NO | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________增加压强,NO的转化率__________(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率__________脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反 应中,在反应ClO![]() +2SO
+2SO![]() ==2SO
==2SO![]() +Cl的平衡常数K表达式为__________。
+Cl的平衡常数K表达式为__________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。已知下列反应:
SO2(g)+2OH(aq)==SO![]() (aq)+H2O(l)ΔH1
(aq)+H2O(l)ΔH1
ClO(aq)+SO![]() (aq)==SO
(aq)==SO![]() (aq)+Cl(aq)ΔH2
(aq)+Cl(aq)ΔH2
CaSO4(s)==Ca2+(aq)+SO![]() (aq)ΔH3
(aq)ΔH3
则反应SO2(g)+Ca2+(aq)+ClO(aq)+2OH(aq)==CaSO4(s)+H2O(l)+Cl(aq)的ΔH=____________。
【答案】(1)①4OH—+3ClO![]() +4NO=4NO
+4NO=4NO![]() +3Cl-+2H2O提高;②减小(2分);③大于(2分);NO溶解度较低或脱硝化反应的活化能较高(2分)
+3Cl-+2H2O提高;②减小(2分);③大于(2分);NO溶解度较低或脱硝化反应的活化能较高(2分)
(2)![]() (2分)(3)△H1+△H2-△H3(2分)
(2分)(3)△H1+△H2-△H3(2分)
【解析】
试题分析:(1)①亚氯酸钠具有氧化性,分析题给数据知NaClO2溶液脱硝过程中主要生产硝酸根和氯离子,利用化合价升降法结合原子守恒和电荷守恒配平,该反应的离子方程式为2OH-+3ClO2-+4NO==4NO3-+3Cl-+2H2O;该反应正反应是气体体积减小的,则增加压强,平衡正向移动,NO的转化率提高。
②根据反应的方程式2H2O+ClO2-+2SO2==2SO42-+Cl-+4H+、2H2O+3ClO2-+4NO==4NO3-+3Cl-+4H+可知随着吸收反应的进行氢离子浓度增大,吸收剂溶液的pH逐渐减小。
③由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高或SO2的溶解度大于NO或二氧化硫的还原性强,易被氧化。
(2)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据反应ClO2+2SO32=2SO42+Cl写出反应的平衡常数K表达式为K=![]() 。
。
(3)已知:①.SO2(g)+2OH(aq)==SO32(aq)+H2O(l)ΔH1;
②.ClO(aq)+SO32(aq)==SO42(aq)+Cl(aq)ΔH2;
③.CaSO4(s)==Ca2+(aq)+SO42(aq)ΔH3
根据盖斯定律知①+②-③可得反应
SO2(g)+Ca2+(aq)+ClO(aq)+2OH(aq)=CaSO4(s)+H2O(l)+Cl(aq)的ΔH=△H1+△H2-△H3。

【题目】
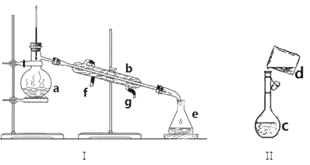
(1)写出下列仪器的名称:
a. b. c. e.
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 。冷凝水由 (填f或g)口通入。
(3)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。
②根据计算得知,用托盘天平所需称量NaOH的质量为 g。
③配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)________。
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶 |
B.称量计算出的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解并冷却至室温 |
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)物质的量浓度误差分析:(填偏高、偏低、无影响)
①用滤纸称量氢氧化钠 ;
②定容时,若眼睛俯视刻度线,则所配制的溶液浓度将 ;
③未冷却到室温就注入容量瓶定容 ;
④配好的溶液转入干净的试剂瓶时,不慎溅出部分溶液 。